| (No se muestran 2 ediciones intermedias del mismo usuario) | |
(Sin diferencias)
| |
Revisión de 14:34 7 jun 2016
Esta voz ofrece un estudio de algunos de los principales tópicos en la filosofía contemporánea de la química, seleccionados de la literatura actual. En la Sección 1 se revisan los obstáculos que han impedido el desarrollo de la disciplina, así como su vigoroso presente. La Sección 2 concierne al antiguo y complejo problema de la relación entre química y física. Dos ejemplos que involucran a estas dos disciplinas –el estatus ontológico de los orbitales atómicos y el problema de la estructura molecular– se analizan en detalle en la Sección 3 y la Sección 4, respectivamente. El problema de la naturaleza del enlace covalente se aborda en la Sección 5. Una de las principales categorías del mundo químico es el concepto de “elemento”, noción que muestra serias dificultades cuando tiene que elucidarse, y que se revisa en la Sección 6. Algunos problemas concernientes a los fundamentos de la tabla periódica –el ícono de la ciencia química– se desarrollan en la Sección 7. El renovado interés en el estudio de las clases naturales en el mundo químico se aborda en la Sección 8. Por último, se describen algunos otros temas objeto de reflexión filosófica, así como las tendencias en este campo de investigación.
Contenido
- 1 Breve historia de la filosofía de la química
- 2 El problema de la relación entre química y física
- 3 El estatus del concepto de orbital
- 4 El problema de la estructura molecular
- 5 La naturaleza del enlace químico
- 6 La naturaleza de los elementos químicos
- 7 Fundamentos de la Tabla Periódica
- 8 Clases naturales en química
- 9 Conclusiones y Perspectivas
- 10 Bibliografía
- 11 Cómo Citar
- 12 Derechos de autor
1 Breve historia de la filosofía de la química ↑
La historia de la filosofía de la ciencia del siglo XX, especialmente la tradición anglosajona, muestra que los problemas filosóficos de la química fueron prácticamente ignorados o descuidados. La obsesión de los filósofos de la ciencia con la física teórica les llevó a prestar poca atención no sólo a la reflexión filosófica sobre la química, sino también a otras ramas de las ciencias. En el caso de la química, esta situación es particularmente sorprendente dada su rica historia como disciplina científica y su posición en el contexto actual de las ciencias naturales. Aunque la química tiene una amplia popularidad desde mediados del siglo XIX, sólo existían unas pocas publicaciones aisladas en el campo de la filosofía de la química en las primeras cinco décadas del siglo XX. En el período de 1949 a 1986, una serie de revistas de Europa del Este publicaron obras filosóficas sobre diversos temas del mundo químico (van Brakel 2000).
Las causas que han impedido el desarrollo de la filosofía de la química son variadas. Entre ellas, la mecánica cuántica ha jugado un papel decisivo en la relación entre química y física: el impresionante éxito de la teoría condujo a muchos físicos y filósofos de la ciencia a aceptar que la química puede ser completamente reducida a la física. Este punto de vista se expresa claramente en el famoso dictum de Paul Dirac en 1929, según el cual la totalidad de la química puede ser deducida a partir de la mecánica cuántica. Este tradicional supuesto no sólo priva a la filosofía de la química de legitimidad como un campo de investigación filosófica, sino que también atenta contra de la autonomía de la química como disciplina científica: mientras que la física resulta ser una ciencia “fundamental” que describe la realidad en sus aspectos más profundos, la química se concibe como una ciencia “meramente fenomenológica”, que sólo describe los fenómenos tal como se nos aparecen. Esta supuesta diferencia entre ambas disciplinas está de acuerdo con la tradicional jerarquía de las ciencias naturales, enraizada en el pensamiento positivista de finales del siglo XIX. Debido a su carácter fundamental, la física se encuentra en la parte superior de la jerarquía, mientras que la química es relegada a una posición inferior, en la medida en que, se supone, puede derivarse de las leyes físicas fundamentales.
En estrecha relación con este supuesto, es posible añadir un realismo ingenuo adoptado, en general, por físicos y químicos: el objeto de nuestro conocimiento es una única ontología. Es decir, sobre la base de un enfoque reduccionista de la relación entre el mundo químico y el mundo físico, la química se considera sólo un capítulo de la física y los químicos son percibidos como científicos que hacen “física aplicada”. Pero, como subraya Nikos Psarros (1998), esto lleva a la conclusión de que la química no es susceptible de análisis filosófico, y esto es en sí mismo una afirmación filosófica.
Existen además otros factores que han contribuido a demorar el desarrollo de la filosofía de la química como subdisciplina. La percepción de que la química está estrechamente vinculada a la tecnología (fabricación de medicamentos, productos industriales, etc.), además de cierta campaña anticientífica, y especialmente antiquímica, en los medios de comunicación junto con los problemas ambientales actuales, no favorecen la imagen de la química en la sociedad. Otro argumento en contra de la existencia de un campo de investigación interdisciplinario entre filosofía y química se refiere a la ausencia de una “crisis” en la ciencia química que haya marcado el curso de su evolución. Esta crisis fue muy importante en el desarrollo de la física a principios del siglo XX con la llegada de la mecánica cuántica y la teoría de la relatividad. Del mismo modo, las teorías neodarwinianas modificaron en gran medida el desarrollo de la biología, cuyo espacio de pensamiento filosófico se inició en la década de 1970.
La negación de la filosofía de la química como un campo legítimo de investigación filosófica sufrió un importante giro a mediados de la década de 1990, especialmente en Gran Bretaña, Estados Unidos y Alemania, junto con algunos grupos aislados en Holanda, Bélgica e Italia que habían surgido a fines de 1980. Desde entonces, químicos, filósofos e historiadores de la química comenzaron a trabajar de manera relativamente formal, celebrando reuniones periódicas en varios países. Además, la construcción de puentes entre la química y las humanidades fue impulsada por la industria química cuando la imagen pública de la química estaba en su peor momento (Schummer 2003). En 1994 se llevaron a cabo una serie de conferencias internacionales en Londres, Karlsruhe, Marburgo y Roma. Desde 1997 la International Society for the Philosophy of Chemistry lleva a cabo simposios anualmente. En los últimos años, el simposio se celebró en Bogotá (2011), Montevideo (2013) y Río de Janeiro (2015) ampliando así la subdisciplina a Sudamérica.
Dos revistas surgieron en este contexto: Hyle – International Journal for Philosophy of Chemistry (desde 1995) y Foundations of Chemistry (desde 1999). Algunas excelentes monografías y antologías se han publicado hasta la fecha por prestigiosas editoriales (Oxford University Press, Boston Studies in the Philosophy of Science, Elsevier). Del mismo modo, un foro de discusión en Internet (Philchem) lidera el intento de sumar a mayor número de químicos y filósofos a esta emergente subdisciplina de la filosofía de la ciencia.
2 El problema de la relación entre química y física ↑
Los historiadores de la ciencia saben muy bien que la química y la física son herederas de tradiciones muy diferentes. La física moderna es el resultado de una combinación inesperada pero fructífera del mecanicismo propuesto por Descartes con el corpuscularismo formulado por Robert Boyle y otros pensadores británicos. Por el contrario, la química se puede considerar como una derivación de la alquimia medieval, de la cual la química heredó un gran interés en sus aplicaciones prácticas. Mientras que la física tuvo como objetivo describir y explicar la realidad “en sí misma”, los principales objetivos de la química siempre implicaron la manipulación y transformación de las sustancias. Como consecuencia de ello, hasta la segunda mitad del siglo XIX, la química y la física eran dos disciplinas independientes, cada una con sus propios objetivos y metodologías.
La situación comenzó a cambiar con el advenimiento de la mecánica cuántica, cuyo impactante éxito dio sustento a la idea de que la química es una rama de la física: la química supuestamente se ocupa de sistemas complejos y procesos particulares que, sin embargo, podrían ser descritos y explicados exclusivamente mediante la teoría cuántica. Ya en 1929 Paul Dirac expresaba la convicción de que, puesto que las leyes fundamentales que rigen el comportamiento de los componentes del átomo se han vuelto conocidas, hacer química significa lidiar con las ecuaciones suministradas por la física: “Las leyes subyacentes necesarias para la teoría matemática de una gran parte de la física y la totalidad de la química son así completamente conocidas, y la dificultad radica en que sólo las aplicaciones exactas de estas leyes llevan a ecuaciones que resultan demasiado complejas para ser resueltas” (Dirac 1929, 714).
La afirmación de Dirac se considera habitualmente como el pronunciamiento más claro acerca de la derivabilidad de la química respecto de la física. Sin embargo, una afirmación anterior del físico Paul Langmuir en 1921 apenas se conoce, aunque expresa una posición aún más fuerte: “Creo que dentro de unos pocos años vamos a ser capaces de deducir el 90 por ciento de todo lo que está en los libros de texto de química, deducirlo como usted lo necesite, desde principios ordinarios simples, conociendo hechos definidos en lo que se refiere a la estructura de los átomos” (citado en Scerri 1994, 162). Esta visión adquirió rápidamente el estatus de un dogma, y fue adoptada por muchos autores que trabajan en los campos de la química, la física y la filosofía.
El problema de la relación entre química y física, generalmente conocido como “el problema de la reducción de la química a la física”, es el tópico de mayor madurez de la subdisciplina. Este problema puede plantearse de la siguiente forma: ¿Cuál es la relación entre el mundo químico y el mundo físico? ¿Es la química una disciplina científica autónoma o, por el contrario, es una mera rama de la física? ¿Existe una relación de interdependencia entre ambas disciplinas?
Cuando el problema a abordar es la reducción, el primer paso es distinguir entre reducción ontológica y reducción epistemológica. En su versión tradicional, la reducción ontológica se refiere a la dependencia ontológica de las entidades, propiedades y regularidades de un estrato de la realidad sobre las entidades, propiedades y regularidades de otro estrato considerado como ontológicamente fundamental. Por lo tanto, el reduccionismo ontológico es una tesis metafísica que postula la prioridad ontológica de un cierto nivel de la realidad a la que todos los otros niveles se reducen directa o indirectamente. La reducción epistemológica se refiere a la relación entre las teorías científicas: una teoría se puede reducir a otra cuando puede deducirse de esta última. Por tanto, el reduccionismo epistemológico es una tesis epistemológica según la cual la ciencia puede ser –o debería ser– unificada deduciendo todas las teorías científicas a partir de una privilegiada.
Sólo en las últimas décadas algunos autores han comenzado a argumentar en favor de la liberación de la química de las limitaciones impuestas por el pensamiento físico. En algunos casos, la autonomía de la química como disciplina científica es defendida sobre la base de argumentos históricos, enfatizando las diferentes tradiciones históricas que han marcado la evolución de la química y de la física (Vancik 1999). Sin embargo, la línea habitual de argumentación propuesta por los filósofos de la química para defender la autonomía de la química señala la imposibilidad de reducir algunos conceptos químicos (ej. composición, enlace o estructura molecular) y propiedades (ej. quiralidad) a la física fundamental. En otras palabras, se argumenta que la reducción epistemológica de la totalidad de la química a la física es imposible. Por ejemplo, Vemulapalli y Byerly (1999) afirman que la reducción epistemológica falla incluso en casos relativamente simples: en general, las propiedades de un sistema químico no pueden explicarse en términos de las propiedades de los microcomponentes físicos; e incluso cuando las propiedades de un macrosistema químico se pueden derivar de esos microcomponentes, esto requiere supuestos adicionales relacionados con los fenómenos macroscópicos.
Van Brakel (1997) analiza la tradicionalmente aceptada reducción de la termodinámica a la mecánica estadística señalando correctamente que, en general, la temperatura no puede definirse como la energía cinética molecular media: esto es verdadero para gases perfectos compuestos de moléculas ideales (“bolas de billar”) en movimiento aleatorio, pero no para sólidos, plasmas o en el vacío. Según van Brakel, todos los problemas que involucran reducción interteórica parecen relacionarse con la noción macroscópica de equilibrio, una noción central de la termodinámica: por ejemplo, el concepto macroscópico de temperatura sólo tiene sentido para sistemas en equilibrio pero, microscópicamente, no hay tal cosa como equilibrio.
Desde una perspectiva similar, Scerri y McIntyre (1997) introducen la distinción entre “reducción cuantitativa” y “reducción conceptual”. La primera se refiere al cálculo de propiedades químicas a partir de teorías físicas, en particular, de la mecánica cuántica. Esta clase de reducción requiere técnicas de aproximación que sólo pueden justificarse sobre una base post hoc, esto es, sobre la base de datos observados experimentalmente. Por otra parte, la reducción conceptual se refiere a la definición de conceptos químicos en términos de conceptos físicos. Según los autores, esta forma de reducción no es posible debido a la propia naturaleza de los conceptos químicos: los conceptos de composición, enlace o estructura molecular no pueden expresarse sino sólo en un nivel químico. Como resultado de la imposibilidad de ambas reducciones, deberíamos “renunciar a reducir epistemológicamente la química a la física” (Scerri y McIntyre 1997, 220).
En resumen, la idea tradicional de que la química es una rama de la física ha comenzado a ser cuestionada al señalarse que los conceptos químicos y las leyes difícilmente se pueden deducir de las teorías físicas. En particular, nociones químicas centrales como enlace, quiralidad, forma molecular u orbital, entre otras, no son susceptibles de tratamiento mecánico-cuántico riguroso. Por supuesto, tal fracaso garantiza la autonomía metodológica de la química como disciplina científica: en la medida en que existan conceptos genuinamente químicos, los químicos pueden continuar con su trabajo sin preocuparse, ya que los físicos no van a reemplazarlos en los laboratorios.
Las discusiones acerca de la supuesta reducción de la química a la física siguen la filosofía tradicional de la ciencia del siglo XX al centrarse en cuestiones epistemológicas: la conclusión es que no todos los conceptos y leyes de la química pueden deducirse a partir de los conceptos y las leyes de la física. Sin embargo, las cuestiones ontológicas normalmente no van más allá de aceptar incondicionalmente la reducción ontológica.
Sin embargo, cuando se ignoran las cuestiones ontológicas se pierde de vista una importante pregunta filosófica: ¿Por qué es la química una ciencia “secundaria”? La respuesta a esta pregunta depende en gran medida del supuesto de la reducción ontológica: si el mundo físico reductor tiene prioridad ontológica sobre el mundo químico reducido, los conceptos químicos que no son reducibles a la mecánica cuántica refieren a entidades aparentes o secundarias dotadas de un estatus ontológico derivado; por ejemplo, la noción de forma molecular resulta ser, en palabras de la Woolley (1982, 4), sólo una “poderosa e iluminadora metáfora”.
Algunos filósofos de la química han dirigido su atención a cuestiones ontológicas relacionadas con el carácter referencial de las descripciones químicas. Uno de ellos es van Brakel (2000), quien afirma que es necesario abandonar el paradigma del espejo de la naturaleza, según el cual cada espejo brinda una imagen autónoma diferente del mundo (o parte de él), pero uno de los espejos –la física ideal– muestra la realidad tal como es (ontológicamente hablando): los otros espejos brindan meras apariencias sin significado cósmico. Según este autor, este paradigma debería abandonarse negando la relación asimétrica entre química y física, y afirmando que no existe descripción privilegiada. Además, van Brakel subraya el hecho de que el fracaso de la reducción epistemológica no tiene implicancia alguna en la interpretación de los conceptos químicos y su relación con lo que es “real”. Si no hay una descripción privilegiada, tanto los conceptos químicos como los mecánico cuánticos pueden ser “poderosas y esclarecedoras metáforas”. Sobre esta base, van Brakel concluye que deberíamos ser lo suficientemente tolerantes para dejar el mismo “espacio ontológico” para el agua “manifiesta”, el agua en términos de la teoría termodinámica de las sustancias, la estructura molecular del agua (“construida” fuera de las mediciones espectroscópicas), las ecuaciones mecánico cuánticas “correctas” para una molécula de agua aislada, y para los experimentos con moléculas de agua aisladas que, dependiendo de la técnica de medición, muestran aproximadamente la estructura molecular “clásica”.
Lombardi y Labarca (2005, 2006) han subrayado que el fracaso de la reducción epistemológica no es lo suficientemente fuerte como para eliminar la idea de una dependencia jerárquica de la química en relación con la física. El rechazo de la posición secundaria de la química y la defensa de la legitimidad de la filosofía de la química requiere una perspectiva filosófica radicalmente diferente, que niega no sólo la reducción epistemológica sino también la reducción ontológica. En este sentido, tales autores proponen un pluralismo ontológico filosóficamente fundado para apoyar la autonomía ontológica del mundo químico y, con ello, revertir la idea tradicional de la “superioridad” de la física en el contexto de las ciencias naturales. Mientras algunos autores se muestran escépticos acerca de los alcances de la autonomía ontológica propuesta (Needham 2006a), otros consideran que esta posición filosófica abre un camino para abordar el problema (Scerri 2005, McIntyre 2007). El debate se ha reanimado recientemente con un trabajo de Manafu (2012) donde se critica la tesis del pluralismo ontológico, y una réplica junto con nuevos argumentos en favor de la autonomía ontológica de la química por parte de Lombardi (2013).
Al mismo tiempo, las nociones de “emergencia” (Luisi 2002, Bishop 2005) y “superveniencia” (Newman 2008) se han propuesto para comprender la relación entre mundo químico y mundo físico. En este complejo escenario, se ha argumentado que, dada la enorme variedad de posibles relaciones interteóricas, la proliferación de definiciones de reducción, superveniencia, emergencia, unificación, etc., un posible camino a seguir es brindar representaciones perspicaces de la práctica de la química, vale decir, analizar casos de estudio y los nuevos debates acerca de ellos, en lugar de proseguir con disputas acerca de si la química puede ser reducida a la física, superviene de ella o ambas disciplinas pueden unificarse, y preocupaciones “metafísicas” similares (van Brakel 2003). Según van Brakel (2003), la pregunta “¿Puede reducirse la química a la física?” carece de sentido ya que los términos ‘química’ y ‘física’ son demasiado vagos. Por tanto, señala el autor, necesitamos preguntas más concretas tales como “¿Se puede brindar una descripción mecánico estadística o mecánico cuántica del punto triple en el equilibrio sólido, gas, líquido?” o bien “¿Podemos entender la noción de ‘sustancia química’ en un discurso mecánico cuántico?”.
3 El estatus del concepto de orbital ↑
Como se destacó anteriormente, la relación entre química y física es uno de los tópicos más debatidos en la filosofía moderna de la química, ya que apunta al corazón mismo de la cuestión sobre la autonomía de la química. En la actualidad, hay un amplio consenso acerca de la imposibilidad de reducir el conjunto de la química a la física: los conceptos y las leyes de la química no pueden ser completamente traducidos ni reducidos a los conceptos y las leyes de la mecánica cuántica. Sin embargo, las cuestiones ontológicas fueron casi ignoradas bajo el supuesto de reducción ontológica: las entidades químicas, cuando se analiza adecuadamente, no son otra cosa que entidades físicas extremadamente complejas. En este sentido, el debate sobre el estatus ontológico de los orbitales atómicos es un ejemplo interesante para ilustrar cómo los problemas filosóficos tienen una repercusión relevante no sólo en los fundamentos de la química, sino también en la forma en que la química se enseña y se aprende.
El concepto de orbital es una noción clave en la ciencia química: se utiliza para explicar enlace, estructura química y reactividad. Las discusiones acerca de su significado quedaron cómodamente confinadas al ámbito epistemológico hasta fines de la década de 1990, particularmente en el campo de la educación en química. Pero el contexto general del debate comenzó a cambiar en septiembre de 1999, cuando una noticia conmocionó a las comunidades química y física. En su portada, la prestigiosa revista Nature anunció que los orbitales atómicos d de la cuprita (Cu2O) habían sido fotografiados por primera vez. Esa primera afirmación fue seguida inmediatamente por una serie de comentarios, y las imágenes obtenidas por el grupo de investigación de la Arizona State University fueron identificadas de manera acrítica con los orbitales atómicos, tal como se presentan en los libros de texto. La noticia fue considerada como uno de los eventos más importantes de la química en ese año, y lo mismo ocurrió en el ámbito de la física.
El informe de la observación de orbitales atómicos llevó el debate directamente al terreno ontológico: ahora el problema resultaba ser la cuestión de decidir acerca de si los orbitales atómicos existen o no. En particular, en la comunidad filosófica se presentaron diferentes argumentos a la conclusión de que la visualización de orbitales es imposible por razones conceptuales. Incluso John Spence, el líder del equipo responsable del experimento, reconoció ese punto: cualquier similitud entre las imágenes reportadas y los orbitales de los libros de texto era totalmente fortuita. Aunque el debate filosófico parecía estar decidido teóricamente en favor de la no observabilidad de los orbitales, distintos experimentalistas siguieron reportando la visualización de orbitales, inclusive de orbitales moleculares.
En dos artículos publicados poco después del anuncio, Eric Scerri (2000a, 2001) enfrentó decididamente el nuevo problema ontológico y expresó su posición con claridad. Según él, los experimentos reportados como “visualización de orbitales” fueron malinterpretados, dado que los orbitales no son observables. Y tal inobservabilidad no depende de deficiencias experimentales, sino del simple hecho de que el término ‘orbital’ carece de referente: los orbitales no pueden ser observados ya que, estrictamente hablando, no existen.
Este debate es una manifestación de un problema que tiene profundas consecuencias para la enseñanza de la química, ya que los docentes de la disciplina no pueden prescindir del concepto de orbital en su enseñanza. Algunos autores han señalado que esta posición choca con el supuesto según el cual la mecánica cuántica tiene la última palabra sobre el tema: sólo el concepto de función de onda es legítimo; el término ‘orbital’ no tiene ninguna referencia en el mundo real. En particular, el punto de vista realista sobre los orbitales adoptado por los profesores de química resulta ser incompatible con su propia posición cuando introducen la mecánica cuántica como la teoría explicativa subyacente de los fenómenos químicos. Este problema es explícitamente señalado por Scerri (2000b) cuando planteó la pregunta: “¿Pueden los orbitales ser reales en química pero no en física?”. Parece bastante claro que esta situación paradójica tiene consecuencias negativas para una profunda comprensión de la disciplina por las siguientes razones: a) los estudiantes se enfrentan a la alternativa de vivir en una especie de “esquizofrenia conceptual” o aceptar que la química describe fenómenos meramente aparentes o “metafóricos”; y b) si la definición “correcta” del concepto de orbital atómico sólo radica en el campo de la física, los estudiantes que deciden estudiar química encontrarían que los libros de texto de su propia disciplina brindan una definición “incorrecta” del concepto. Esta situación parece ser también inadecuada desde el punto de vista metodológico.
Como era de esperar, algunos educadores químicos reaccionaron al enfoque normativista de Scerri, afirmando que la interpretación no-realista tendrá poco impacto sobre el uso de los orbitales en la enseñanza de la disciplina. A partir de ésta y otras críticas, Scerri (2006) comenzó a mitigar su posición adoptando finalmente una posición intermedia: si bien los orbitales no pueden observarse de acuerdo con la mecánica cuántica, los profesores pueden emplearlos de manera realista pero señalando cuidadosamente sus limitaciones.
Labarca y Lombardi (2010) han analizado el problema del concepto de orbital a la luz de los argumentos que niegan su carácter referencial desde el punto de vista ontológico. El punto de partida fue analizar la relación entre mecánica cuántica y química molecular. Mientras que en mecánica cuántica ‘orbital’ es un término que no refiere, en química molecular los orbitales existen como regiones espaciales que explican la forma de las moléculas locales e individuales. El argumento para rechazar la existencia de orbitales, señalan los autores, se basa en una premisa fundamental: la identificación entre ‘orbital’ y ‘función de onda’. Los autores ponen en cuestión tal identificación preguntándose entonces si éste es el concepto de orbital utilizado en química para hablar de las formas de los orbitales o para explicar el enlace químico. Algunos autores han cuestionado estas afirmaciones, señalando que dependen de cómo se interpreten los términos ‘orbital’ y ‘observación’ (Mulder 2011).
4 El problema de la estructura molecular ↑
La noción de estructura molecular tiene un papel explicativo central en química. La idea de una disposición tridimensional definida de átomos unidos por una red de enlaces químicos que posee movimiento translacional, rotacional y vibracional es uno de los pilares de la ciencia química. Sabemos que la forma de las moléculas determina sus propiedades físicas, químicas y biológicas. El modelo clásico de estructura química ha actuado como una fructífera guía en la investigación química desde mediados del siglo XIX, y alguna veces es denominada “teoría molecular folk” (folk molecular theory) (Ramsey 1997).
La controversia acerca del estatus ontológico del concepto de estructura molecular tuvo su punto de partida en el controvertido y desafiante artículo del químico teórico Guy Woolley en 1978 (Woolley 1978). El autor señala que, desde el punto de vista de la teoría cuántica, la noción de estructura molecular no es una propiedad intrínseca de los sistemas químicos. En el mismo sentido, Primas (1983) puntualiza que la estructura molecular es sólo una poderosa y reveladora metáfora que no se corresponde con la realidad descrita por la mecánica cuántica. Weininger (1984) sostiene que, de ser así, la idea fundamental de que las moléculas se construyen de forma aditiva a partir de los átomos, que conservan su identidad esencial dentro de la molécula, se pone en tela de juicio. Sin embargo, Woolley (1982) hace hincapié en que el concepto de estructura molecular no debe ser abandonado en química, al tiempo que recuerda que dicha noción surgió en un contexto científico muy diferente del actual. Por su parte, como señala Scerri (2000b), la mayoría de los químicos reaccionaría con incredulidad a la idea de que la estructura molecular es sólo una “iluminadora metáfora”, ya que es un concepto central en la química moderna. La evidencia de su existencia proporcionada por la espectroscopia y otras modernas técnicas de microscopía rechazaría tal punto de vista. Precisamente sobre esta base Ramsey (1997) defiende una interpretación realista del concepto de estructura molecular. Argumenta que, mediante el uso de una descripción física del concepto, se aprecia que es ontológicamente reductible, aunque de manera aproximada. En consecuencia, la estructura molecular es un concepto aproximado con límites definidos. Además, señala –contra Woolley y Primas– que cuando el concepto se interpreta correctamente, es un “objeto de creencia”.
De acuerdo con el reduccionismo ontológico, la química molecular refiere a la ontología cuántica; por lo tanto, los compromisos ontológicos de la química resultan estar basados finalmente en la mecánica cuántica. Lombardi y Castagnino (2010) afirman que la confianza en la existencia de las entidades físicas descritas por la mecánica cuántica no tiene en cuenta los problemas de interpretación de la teoría, las dificultades se observan solamente del lado de la química, mientras que las cuestiones altamente controversiales del lado de la física se ignoran. Los autores analizan como ejemplo el caso de la aproximación de Born-Oppenheimer, tradicionalmente el recurso formal para conectar las descripciones químicas y cuánticas de sistemas moleculares. Lombardi y Castagnino señalan que una importante cuestión del lado de la física permanece inadvertida: el hecho de que los núcleos puedan ser tratados como partículas clásicas se encuentra en conflicto con la interpretación ortodoxa de la mecánica cuántica.
Admitiendo que la forma molecular no es un fenómeno del que puede dar cuenta la mecánica cuántica por sí misma, algunos autores han recurrido a la idea filosófica de emergencia. Tal es el caso de Hendry (2010), quien apela a dicha noción como una forma de superar el estancamiento actual en el que se encuentra el debate concerniente a la reducción epistemológica de la química, según su consideración. En particular, el autor propone la idea de ‘emergencia ontológica’ de la estructura molecular con respecto a los sistemas mecánico-cuántico de núcleos y electrones que interactúan mediante fuerzas electrostáticas.
En un artículo relativamente reciente, Cerro y Merino (2009) ponen en cuestión las limitaciones del modelo clásico. Los autores analizan el caso de las moléculas con una estructura fluxional –es decir, en constante cambio–, por ende sin una estructura definida como el ciclohexano, el pentacarbonilo de hierro y el pentafluoruro de fósforo. Y aún más interesante es el caso del bulvaleno (C10 H10) donde los átomos de carbono y de hidrógeno son equivalentes, y a la temperatura de 120°C carece de enlaces carbono-carbono permanentes. La existencia de estas moléculas les permite a los autores argumentar en favor de concebir la estructura molecular como una propiedad dinámica de respuesta, y no como una propiedad estática.
La noción de estructura molecular está estrechamente relacionada con la idea de identidad molecular. En efecto, en casi todas las descripciones químicas se considera que una molécula conserva su identidad cuando cambia su forma o estructura mediante vibraciones o rotaciones, pero la pierde cuando se forman o se rompen enlaces covalentes para producir una nueva estructura. Así, el concepto de estructura molecular concentra interesantes preguntas, a saber: ¿Es un concepto reductible o irreductible? ¿Es simplemente una noción que no tiene ninguna relación con la realidad? ¿Es un aspecto esencial de la identidad molecular?
Como puede observarse, el origen del conflicto sobre la interpretación de la forma molecular tiene sus raíces en el advenimiento de la mecánica cuántica en el campo de la química. Desde esta perspectiva, la noción de estructura carece de referente, dada la incerteza de la posición y de la trayectoria de los componentes moleculares. Pero, al mismo tiempo, el concepto de estructura molecular desempeña un papel central en las explicaciones químicas, incluso sobre un tema tan básico como la identidad de las moléculas. ¿Cuál es entonces el referente del término ‘estructura molecular’? El debate, como se observa, está lejos aún de saldarse.
5 La naturaleza del enlace químico ↑
La noción de “enlace” es uno de los conceptos centrales de la ciencia química. De hecho, muchas de las investigaciones en la química moderna se enfocan sobre las propiedades dinámicas y el enlace químico. Las teorías actuales sobre el tema son herederas de los trabajos de Irving Langmuir, Walther Kossel y, sobre todo, de Gilbert Newton Lewis en las primeras décadas del siglo pasado. Con notable perspicacia, Lewis desarrolló su teoría varios años antes de la aparición de la mecánica cuántica y del concepto de orbital. En 1916 publicó un artículo, “El átomo y la molécula”, que permitió la comprensión de la naturaleza de los enlaces entre átomos no metálicos. El artículo también sentó las bases de nuestra comprensión actual de otro concepto fundamental de la química moderna: la estructura molecular. La teoría desarrollada por Lewis conceptualiza un enlace covalente como un par de electrones compartidos entre átomos.
Con el advenimiento de la mecánica cuántica en 1925-1926, una molécula se trata entonces como un sistema de electrones y núcleos que interactúan electrostáticamente. La concepción mecánico cuántica del enlace químico condujo a muchos de los esfuerzos para desarrollar las funciones de onda para la descripción de las propiedades de un átomo o una molécula dentro del formalismo de dicha teoría. De esta manera, dos teorías rivales proporcionaban una descripción del enlace químico en términos formales: la teoría de enlace de valencia (EV) y la teoría del orbital molecular (OM).
5.1 La teoría del enlace de valencia ↑
La primera aplicación de la mecánica cuántica a un sistema químico fue desarrollada por los físicos alemanes Walter Heitler y Fritz London en 1927, y se convirtió en la base para los tratamientos posteriores del tema. En este trabajo los autores utilizan una técnica perturbacional para resolver la ecuación de Schrödinger independiente del tiempo de una función de onda electrónica construida para representar la molécula de hidrógeno (H2). Para elaborar tal función de onda, el sistema se concibe compuesto de dos núcleos y dos electrones completamente separados. Sobre esta base, la función de onda se representa como sigue:
donde 1 y 2 representan los electrones y Ψa y Ψb denotan las funciones de onda atómicas del hidrógeno en el estado basal (1s) para los núcleos a y b respectivamente. Debido a que los electrones son partículas indistinguibles y cumplen con el principio de exclusión de Pauli, existiría también una segunda posibilidad equivalente para representar la molécula en la cual los electrones cambian de núcleo al cual se encuentran asociados:
Estas dos posibilidades son dos descripciones igualmente aceptables del sistema, de modo que la mejor forma de representar la molécula de H2 es mediante una combinación lineal de las dos posibilidades:
Al resolver esta ecuación para encontrar la energía del sistema enlazado, se encontró que en el enlace del hidrógeno molecular hay un fuerte componente electrostático, pero la mayor parte de la energía provenía de la naturaleza mecánico cuántica del sistema, que fue descrita como una energía de intercambio o de resonancia, la cual corresponde al intercambio de los dos electrones tal como se describe en el enfoque EV.
Si bien es posible diseñar estructuras de Lewis que representen las posiciones de los electrones en las moléculas, de acuerdo con la mecánica cuántica el estado real de la molécula es un híbrido entre diferentes estructuras resonantes clásicamente ligadas y, por tanto, se representa como una superposición de los estados correspondientes a tales estructuras clásicas. Sin embargo, la EV no queda al margen de la química estructural, porque cada término de la función de onda corresponde a una estructura química definida.
El trabajo de Heitler y London fue considerado como la demostración de la base mecánico cuántica del enlace químico. De acuerdo con Harris (2008), este trabajo ha constituido la base del argumento según el cual la química puede ser teóricamente reducida a la física. Pese a la amplia aceptación del trabajo inicial de Heitler y London, Linus Pauling fue el responsable de popularizar el enfoque EV dentro de la química. En particular, la generalización a las moléculas poliatómicas se debió a los trabajos de Pauling, John C. Slater, Henry Eyring, Michael Polanyi y George Wheland.
5.2 La teoría del orbital molecular ↑
Al mismo tiempo que se desarrollaba la EV, surgió un enfoque alternativo para explicar el enlace químico. La teoría del orbital molecular se basaba en dos supuestos fundamentales. El primero de ellos, denominado campo autoconsistente (SCF por sus siglas en inglés), considera que para un electrón cualquiera su distribución de carga media es exactamente igual a la obtenida cuando de la ecuación de Schrödinger se toma el campo potencial como debido a las cargas de los núcleos y al promedio de la carga de los otros electrones. Para obtener la función de onda de un electrón se requiere asumir la función de onda de los otros, y para encontrarla es necesaria una segunda suposición: cuando un electrón está cerca de un núcleo particular en un sistema molecular, todas las fuerzas que actúan sobre él son debidas a ese núcleo y a los electrones cercanos al mismo. La función de onda de ese electrón es muy aproximada a la función de onda del átomo aislado. Para representar estas dos características básicas de la OM, la manera más apropiada para generar una función de onda molecular para cada electrón es mediante una combinación lineal de orbitales atómicos (CLOA). Esta función de onda se denomina orbital molecular y de ahí debe su nombre la teoría. La misma se debió principalmente a la obra de Friedrich Hund y Robert Mulliken, con importantes contribuciones de John Lennard-Jones, Erich Hückel y Charles Coulson.
En el caso de la molécula de hidrógeno los dos orbitales atómicos (1s) del estado basal se pueden combinar de dos maneras diferentes. La primera combinación Ψs da como resultado una función simétrica con respecto al plano de los dos núcleos, y la segunda Ψa da como resultado una función antisimétrica:
La combinación simétrica es de menor energía que la de los orbitales atómicos 1s del hidrógeno separados; por ello, en este caso, el orbital molecular se denomina de enlace. Cuando la combinación es antisimétrica el orbital molecular es de antienlace. Los electrones en una molécula descrita por la OM son añadidos de forma adiabática al sistema molecular, de tal manera que primero ocupan los orbitales moleculares de menor energía y, dado el principio de exclusión de Pauli, sólo pueden ocupar orbitales moleculares un par de electrones que tengan espín contrario. Según la OM, la combinación de orbitales moleculares que son ocupados por diferentes electrones es la mejor manera de describir una ecuación de onda para la molécula de hidrógeno, en la cual los dos electrones se encuentran en el orbital molecular de enlace Ψ
A diferencia de la descripción que brinda la EV, en la OM un solo electrón puede describir la función de onda de un sistema molecular. Este es el caso de un orbital molecular ocupado por un electrón en la molécula H2+, el cual permite asociar un mismo electrón a dos núcleos atómicos diferentes.
La OM fue considerada como una mejor alternativa para superar los límites mostrados tanto por la teoría electrónica de Lewis como por el modelo de repulsión de pares de electrones de la capa de valencia (RPECV). En particular, OM puede explicar fenómenos tales como la presencia de compuestos deficientes en electrones (por ejemplo, el diborano), la estabilidad de las especies H2+ y el paramagnetismo del oxígeno. En esta teoría, los electrones ya no se encuentran en los átomos o entre pares de átomos, sino que están deslocalizados en toda la molécula y ocupan orbitales denominados ‘orbitales moleculares’. Esto implica que los electrones ya no se limitan a los enlaces individuales; por el contrario, la teoría asigna electrones a la totalidad de la molécula. Por lo tanto, el enlace covalente se describe ahora en términos de orbitales moleculares distribuidos en toda la molécula.
5.3 Dos explicaciones del enlace químico ↑
Un análisis superficial de las dos teorías podría llevar a concluir que OM y EV sólo difieren en el conjunto de aproximaciones necesarias para generar la función de onda. Sin embargo, una reflexión más detenida revela que hay profundas diferencias conceptuales entre estas dos explicaciones.
La primera diferencia importante reside en la construcción de la función de onda. EV se centra en el par de electrones responsable de la unión covalente mediante el análisis de la molécula de H2. Por su parte, OM toma una especie molecular, el ión hidrógeno molecular H2+, como punto de partida. Así, en la EV, los electrones se localizan en enlaces individuales, mientras que en la OM, por el contrario, los electrones están deslocalizados en los orbitales moleculares en toda la molécula. Otra divergencia consiste en la representación de la molécula suministrada por las dos teorías. En la EV una molécula se representa como un grupo de átomos unidos entre sí por medio de la superposición localizada de orbitales atómicos de la capa de valencia. Por el contrario, en la OM una molécula se representa como una colección de núcleos con orbitales moleculares deslocalizados en toda la molécula.
Ahora bien, ¿cuál ha sido el grado de aceptación de ambas teorías en la comunidad científica? En el momento de su formulación, EV fue adoptada inmediatamente por los químicos, siendo la primera teoría que describió cuantitativamente un enlace químico. Sin embargo, OM comenzó gradualmente a ganar aceptación debido a su fácil aplicación en las computadoras. A pesar del predominio de esta teoría en la química computacional, los químicos utilizan el esquema conceptual de la EV, principalmente en química orgánica para el diseño de nuevas moléculas y nuevas reacciones.
Desde la década de 1980, EV comenzó a resurgir convirtiéndose en una alternativa atractiva a OM, aunque debe puntualizarse que nunca fue eclipsada por OM en los libros de texto de introducción a la química. La mayoría de los químicos aceptaron la superioridad de OM sobre EV para los estudios cuantitativos, pero continuaron empleando esta última debido a su claridad conceptual para racionalizar las ideas químicas en forma cualitativa. Actualmente, ambas teorías desempeñan papeles complementarios (Shaik y Hiberty 2008), y su uso depende de los factores considerados relevantes para cada propósito: fácil implementación computacional, fácil visualización, ventaja para la enseñanza, etc.
En la nueva literatura filosófica sobre el tema, el punto de partida es el trabajo de Robin Hendry (2008a). Este autor establece dos concepciones del enlace químico: la estructural y la energética. La primera tiene sus raíces en la teoría química estructural que se inició alrededor de 1860 a partir de los trabajos de August Kekulé; de acuerdo con esta teoría, una molécula es una entidad compuesta de dos o más átomos que se mantienen unidos. El propósito central de la concepción estructural del enlace covalente es retener las ideas explicativas suministradas por las fórmulas estructurales clásicas. Por lo tanto, desde este punto de vista, los enlaces químicos son, al menos para las sustancias moleculares, las partes materiales de la molécula responsables de las relaciones submoleculares espacialmente situadas entre los centros atómicos individuales. Esta concepción sigue guiando la práctica de la química sintética.
Hendry afirma que la concepción estructural se enfrenta a algunos retos: el holismo mecánico cuántico y la deslocalización de electrones, por un lado, y el problema de las sustancias cuyas estructuras no pueden ser adecuadamente representadas por las fórmulas clásicas de valencia, por otro. Los primeros desafíos provienen de la incompatibilidad entre la ontología de la química estructural y la ontología de la química cuántica. Dado que, en principio, los electrones no pueden distinguirse (no tienen individualidad), la descripción de la mecánica cuántica no puede depender de la identidad de los electrones individuales. En el modelo de Lewis los enlaces están compuestos de electrones localizados, lo que no ocurre en OM, como se ha visto. El último desafío proviene de aquellas sustancias que presentan limitaciones a la regla del octeto (por ej. BeCl3, PF5, SF4). Sin embargo, afirma Hendry, estos casos fueron objeciones a la regla del octeto más que a la concepción clásica de enlace químico como un par de electrones compartidos. Otro tipo de argumento ha apelado a la dimensión pragmática para defender la concepción estructural, dado su éxito empírico en descubrir y sintetizar nuevas sustancias (Stemwedel 2006).
Por su parte, la concepción energética, en lugar de buscar las partes materiales responsables de la unión de la molécula como un todo, se centra en los cambios de energía comunes a todos los casos de enlace químico. En este sentido, el enlace implica la estabilización energética de la molécula. Esta concepción se refiere así a una teoría del enlace químico en lugar de una teoría de los enlaces. En otras palabras, mientras que el enlazamiento es real, los enlaces no lo son.
Ahora bien, ¿es posible afirmar que EV y OM son efectivamente teorías científicas? Si bien los términos ‘teoría’ y ‘modelo’ suelen ser utilizados como sinónimos por los científicos, algunos trabajos recientes se han ocupado del tema. En este sentido, sobre la base de la comparación entre ambos enfoques, se ha argumentado que no puede hablarse de teorías científicas en sentido estricto, sino que se ajustan mejor a la noción de ‘modelo’ (Lombardi y Martínez González 2012, Adúriz-Bravo, Labarca y Lombardi 2014).
Como vemos, aunque el concepto de enlace químico juega un papel central tanto en las explicaciones químicas como en las predicciones, su elucidación no es una tarea sencilla. Los diferentes enfoques teóricos -de la concepción clásica de Lewis a los divergentes marcos teóricos de la química cuántica- ponen de relieve que el concepto de enlace covalente sigue siendo difícil de dilucidar. Estos enfoques coexisten en la práctica química y, en consecuencia, parecería natural argumentar en favor de un enfoque pluralista para entender la naturaleza del enlace químico, enfoque defendido por algunos químicos teóricos y filósofos de la química. Uno de ellos es el Premio Nobel Roald Hoffman, quien afirmó que “cualquier definición rigurosa de un enlace químico está destinada a ser empobrecedora”; por tanto, aconseja “divertirse con la difusa riqueza de la idea” (citado en Ball 2011, 28).
6 La naturaleza de los elementos químicos ↑
Junto con las nociones de sustancia y estructura, el concepto de ‘elemento’ es una de las categorías centrales del mundo químico: juega un papel relevante tanto en las reacciones químicas como en el sistema periódico. Con el advenimiento de la filosofía moderna de la química en la década de 1990, una nueva generación de filósofos de la química, químicos e historiadores de la química intentó clarificar la noción de ‘elemento’. Dicha tarea puso de relieve la complejidad del problema científico-filosófico, dado tanto el carácter polisémico del concepto como, asimismo, las divergencias en cuanto a la terminología a emplear. La pregunta “¿qué es un elemento?” ha sido motivo de un largo debate desde los albores de la filosofía griega hasta nuestros días. En este sentido, químicos y filósofos de la química han identificado diferentes sentidos en los que se interpreta actualmente el término ‘elemento’.
El primero de ellos considera los elementos como fueron concebidos por los antiguos filósofos griegos. Empédocles elaboró la llamada “doctrina de los cuatro elementos”: agua, aire, tierra y fuego eran las partes constitutivas de la realidad natural. Según Aristóteles, estos elementos se determinan por las características de calor, frío, sequedad y humedad. Algunos de los filósofos presocráticos creían que tales elementos estaban formados por componentes microscópicos de formas variadas, lo cual explicaba la diversidad de sus propiedades. Las formas básicas de tales elementos eran la de los sólidos platónicos (tetraedro, octaedro, icosaedro y cubo). Cuando tiempo después se descubre un quinto sólido platónico, el dodecaedro, Aristóteles postula el éter como el “quinto elemento” o quintaesencia. La doctrina de los cuatro elementos ejerció gran influencia en la Antigüedad y en la Edad Media, y hasta bien entrada la época moderna.
Los filósofos griegos concibieron todas las sustancias compuestas por los cuatro o cinco elementos. Pero algunos de ellos creyeron que, además de un sentido composicional, estos elementos subyacían a todas las demás sustancias. Por tanto, los elementos se concibieron como principios, tendencias o potencialidades que daban lugar a sus propiedades observables. Surgía así la distinción entre la forma abstracta (o inobservable) de un elemento y su forma observable. Esta distinción ejerció un importante papel en el desarrollo de la química. Pero cuando la revolución científica hizo su entrada en escena, la concepción abstracta fue parcialmente abandonada.
En efecto, a fines del siglo XVIII Antoine-Laurent de Lavoisier fue el primero en concebir un elemento como la etapa final de la descomposición química; surgía así su caracterización sobre la base de la observación y la manipulación. En 1789 Lavoisier y sus colaboradores publicaron su famosa lista de 33 elementos como “cuerpos simples” o “sustancias simples”. La segunda conceptualización del término ‘elemento’ que aparece en la historia refiere entonces al dominio macroscópico: elementos como sustancias simples observables y tangibles que se pueden aislar. Esta caracterización de la noción de ‘elemento’ se encuentra comúnmente en los libros universitarios de química general.
Sin embargo, el sentido abstracto del término ‘elemento’ fue revalorizado por el químico ruso Dmitri Mendeleev en la década de 1860, al señalar que pese a que un elemento puede ser visto como una “sustancia simple” (aislable) con propiedades macroscópicas, también puede ser concebido como una “sustancia básica” (invisible) con una sola propiedad: su peso atómico. Según Mendeleev, el cuerpo simple y el compuesto quedan relegados al mundo de las apariencias. Si bien el elemento como sustancia básica no tiene existencia fenoménica, pues siempre está “escondido” en un cuerpo simple o compuesto, es el único principio explicativo, el sustrato de todo lo observable. Esta profunda distinción conceptual entre un elemento concebido como “sustancia básica” y como “sustancia simple” fue crucial para su propuesta del sistema periódico. Mendeleev hizo hincapié en que su clasificación periódica concernía con los elementos concebidos en un sentido abstracto y no en un sentido macroscópico, es decir, no con elementos como suelen encontrarse en frascos y botellas en los laboratorios (Scerri 2007).
A comienzos del siglo XX, el descubrimiento de la isotopía representaba una amenaza para la tabla periódica, puesto que el número de elementos como “sustancias simples” parecía aumentar muy rápidamente. Algunos químicos afirmaron entonces que la denominada “crisis de los isótopos”, tal como el evento fue conocido, implicaba el fin de la clasificación periódica como era conocida hasta entonces. Pero el radioquímico austríaco Fritz Paneth resolvió la crisis recordando la distinción filosófica de Mendeleev entre “sustancia simple” y “sustancia básica”. En consecuencia, el descubrimiento de los isótopos concernía con nuevos elementos concebidos como “sustancias simples”, pero el criterio primario de clasificación periódica implicaba el elemento en un sentido más fundamental del término. Asimismo, Paneth y Hevesy, trabajando con plomo y “radio plomo” (uno de los isótopos descubiertos) que Rutherford les había pedido separar químicamente, corroboraron la inseparabilidad química de los mismos, lo cual significaba que se trataba de dos o más formas del mismo elemento químico.
Siguiendo los trabajos de Anton van den Broek, en 1913 Henry Moseley estableció que el número atómico era un mejor criterio para ordenar los elementos que el peso atómico. Sobre la base de este aporte, por un lado, y del trabajo de Fritz Paneth por el otro, en 1923 la IUPAC (Unión Internacional de Química Pura y Aplicada) modificó la propiedad esencial de un elemento químico, pasando del peso atómico al número atómico (Scerri 2007). De este modo, surgía entonces la tercera concepción de “elemento químico”: la que identifica un elemento por su carga nuclear, es decir, con el número de protones en su núcleo. Esta caracterización fisicalista constituye el criterio primario de clasificación primaria para ordenar los elementos, la cual es respaldada por la IUPAC así como es recogida por muchos libros de texto de química.
Muchas reflexiones filosóficas actuales sobre el tema toman el trabajo de Lavoisier como punto de partida. Como fue señalado, Lavoisier brindó una concepción empírica de los elementos como la etapa final del análisis y renunciaba, así, a la idea de los elementos como “sustancias básicas” en favor de considerar los elementos como “cuerpos simples”, para usar una traducción de su propio término en francés corps simples. Robin Hendry (2005, 2006a) ha desafiado este punto de vista, afirmando que no hay evidencia histórica de la intención de Lavoisier de privar a la química del sentido anterior de ‘elemento’. Según el autor, por el contrario, hay una continuidad conceptual en el papel teórico asignado a los elementos en las explicaciones químicas desde, al menos, el siglo XVIII.
Otros autores se han concentrado en el influyente trabajo de Paneth (1931, [2003]). Estos autores, si bien comparten en líneas generales dicha perspectiva, aportan comentarios, críticas y presentan visiones particulares del problema (Earley 2009, Ruthenberg 2009, Scerri 2012). Por ejemplo, Earley (2009) discute si los términos ‘sustancia simple’ y ‘sustancia básica’ son traducciones apropiadas de los términos alemanes ‘einfacher stoff’ y ‘grundstoff’, respectivamente, tal como fueron empleados por Paneth en su versión original. Por su parte, Scerri (2012) sugiere una posible crítica al trabajo de este autor, con el propósito de aclarar una cierta confusión en la relación existente entre los conceptos de sustancia básica, sustancia simple y elemento. Considera que la distinción de Paneth, tal como fue presentada, puede inducir a interpretar que “elemento” es la entidad fundamental, y que “sustancia básica” y “sustancia simple” son, de alguna manera, nociones derivadas de la noción más fundamental de “elemento”. Scerri introduce entonces el término ‘sustancia simple combinada’ para referirse a las sustancias compuestas por más de un elemento. Esto le permite resaltar que la noción de sustancia básica subyace tanto a la sustancia simple como a la sustancia simple combinada. Y afirma entonces que el sistema periódico, si bien se ordena a partir de los elementos concebidos como sustancias básicas, incluye asimismo a las sustancias simples combinadas, las cuales manifiestan asimismo periodicidad (reactividad química, propiedades físicas, etc.).
La naturaleza dual del concepto de elemento es resistida por algunos filósofos contemporáneos de la química desde posturas alternativas (Hendry 2006b, Needham 2006b, Vihalemm 2011). Estos autores, en líneas generales, niegan cualquier sentido metafísico a los elementos, y proponen superar las dificultades encontradas mediante una nueva perspectiva conceptual que incluye, en ciertos casos, una nueva terminología.
La pregunta sobre si los elementos como “sustancias básicas” deben considerarse como átomos neutros, átomos unidos o como elementos macroscópicos caracterizados por sus números atómicos concentran también las discusiones. Estas reflexiones filosóficas conducen naturalmente a las siguientes preguntas: ¿Qué representa tabla periódica actualmente? ¿Los elementos concebidos como “sustancias básicas” o los elementos concebidos como “sustancias simples” en el estado estándar de temperatura (298 K) y de presión (1 atm)? Como vemos, una buena cantidad de trabajo resta aún por hacer.
7 Fundamentos de la Tabla Periódica ↑
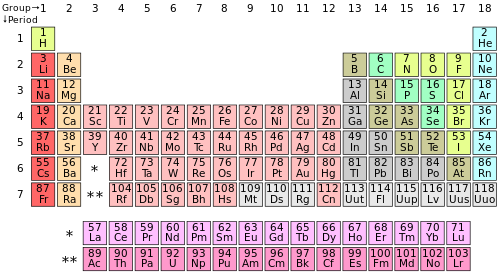
La tabla periódica de los elementos es uno de los principales íconos de la ciencia contemporánea. El sistema periódico, que subyace a la tabla periódica, es una de las grandes ideas de la química ya que proporciona la manera de entender cómo los elementos reaccionan entre sí y ayuda a explicar las propiedades de los mismos.
Con la activa participación de químicos, físicos, historiadores, filósofos de la química y, en algunos casos, de científicos amateurs, varios son los temas en discusión, a saber: ¿Cuál es el origen de la tabla periódica? ¿Hay una mejor forma de presentar los elementos en el sistema periódico? ¿Puede la tabla periódica ser reducida a la mecánica cuántica? ¿Cuáles son las posiciones adecuadas para el hidrógeno y el helio? ¿Qué elementos deben formar el grupo 3? ¿Cuál es el papel de las tríadas de número atómico? ¿Cuál es el estatus de la ley periódica? A continuación, presentamos brevemente algunos de los debates sobre estos temas.
7.1 El problema de la forma óptima ↑
A poco más de 140 años de la publicación de la primera tabla periódica de Mendeleev, se han presentado más de mil variantes de la misma; la forma de la tabla periódica es aún hoy objeto de interminables debates en el plano epistemológico. El punto central consiste en si existe una mejor manera de ubicar los elementos o, en otras palabras, si es posible una mejor representación de la periodicidad.
Algunos investigadores como Stewart, Rich y Laing afirman que es inútil tratar de encontrar una única representación de los elementos que dé cuenta de todas las relaciones importantes entre ellos. La mejor representación es sólo una cuestión de conveniencia y convención (Stewart 2005). Este punto de vista instrumentalista fue desafiado durante varios años por Eric Scerri (2007), quien defendió una posición realista, según la cual debe existir una mejor manera de ordenar los elementos en grupos de columnas, y es tarea de los filósofos de la química tratar de encontrar dicha forma óptima. Naturalmente, esto implica que algunas presentaciones del sistema periódico son superiores a otras. Sin embargo, Scerri abandonó finalmente la insistencia en dicha idea. Pero entonces, una pregunta clave es: ¿Cuál es la posición de la IUPAC con relación a los múltiples diseños existentes de la tabla periódica? ¿Existe alguna recomendación sobre el tema? La opinión de la División de Representación de la Estructura y Nomenclatura Química es clara: la IUPAC reconoce que una sola tabla no se ajusta a todos los usos; por tanto, avala la proliferación de representaciones del sistema periódico. Asimismo, la tabla periódica como la conocemos hoy día (Figura 1) es un ícono a menudo asociado con la IUPAC, aunque erróneamente: esto significa que ninguna forma específica de la tabla periódica ha sido aprobada por dicha institución (Leigh 2009).
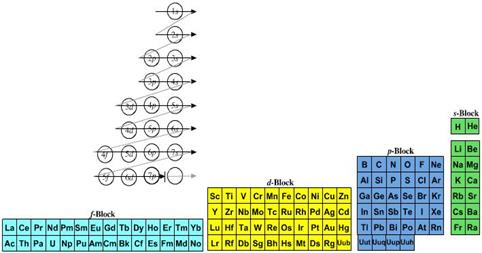
Se ha sugerido que una base más satisfactoria para la representación del sistema periódico se alcanzaría si se comenzara cada período con valores de n + l (la suma de los dos primeros números cuánticos), en lugar de utilizar solamente n, ya que n + l posee un estatus más fundamental (véase Figura 2). A pesar de la tradicionalmente aceptada representación bidimensional, algunos autores han cuestionado este punto de vista al proponer representaciones tridimensionales, lo cual deja de lado el tradicional concepto de ‘tabla’. Una de ellas, denominada “Árbol de los Elementos”, fue propuesta por Fernando Dufour en 1990, y destaca ciertas similitudes químicas no incluidas en la tabla de dos dimensiones. En 2005 Stewart diseñó la representación del sistema periódico como un espiral tridimensional, conocida como “Galaxia Química”, cuya ventaja radica en la eliminación de los espacios entre los gases nobles y los metales alcalinos, como en la tabla periódica tradicional, enfatizando así la continuidad entre los elementos.
Una tabla que actualmente concentra la atención de los expertos es la denominada “tabla periódica de escalón izquierdo", propuesta por el ingeniero francés Charles Janet en 1929 y diseñada según un criterio estético (Figura 2). Esta tabla fue revivida por el educador en química Gary Katz en 2001 (Katz 2001).
A diferencia de la tabla periódica tradicional, en la tabla periódica de escalón izquierdo el helio se ubica encabezando los metales alcalino-térreos. Como resultado, todos los elementos de este grupo tienen dos electrones en la capa de valencia. Una segunda característica es que el bloque s completo se ha desplazado a la derecha y el helio es parte de él. Sin embargo, que dicho elemento se encuentre fuera del grupo de los gases nobles es considerado desagradable por algunos químicos. Aunque no hay duda de que este elemento debe integrar el grupo de los alcalino-térreos según su configuración electrónica, algunos químicos han rechazado esta estrategia al afirmar que el principal objetivo de la tabla periódica es representar las propiedades químicas de los elementos y no sus configuraciones electrónicas; actualmente existe un intenso debate al respecto (Scerri 2013, Labarca 2013, Tsimmerman 2013). Otra característica que posee la tabla de Janet es que los lantanoides y actinoides se incorporan al cuerpo principal de la misma. Una de las virtudes de su diseño es que muestra una forma regular, evitando así “huecos” entre grupos de elementos, como el existente entre berilio y magnesio con boro y aluminio, tal como se presenta en la tabla periódica convencional. Además, la tabla convencional muestra un primer periodo de sólo dos elementos (hidrógeno y helio); por el contrario, en la representación de Janet todas las longitudes de periodo se repiten según la secuencia 2, 2, 8, 8, 18, etc.
7.2 La ubicación del hidrógeno y del helio ↑
Generaciones de químicos y físicos han debatido acerca de la mejor ubicación del hidrógeno y del helio en el sistema periódico. En relación con el hidrógeno, las opciones usualmente consideradas son: a) en el grupo 1 (metales alcalinos), ya que posee un electrón en la capa de valencia; b) encabezando el grupo 17 (halógenos), dado que los átomos de hidrógeno pueden formar iones negativos, al igual que los elementos de ese grupo; c) en el grupo 14, el grupo del carbono, dado que el hidrógeno muestra la mitad de su capa de valencia completa (2 electrones), al igual que el carbono (4 electrones); o bien por su electronegatividad; y finalmente, d) “flotando” sobre el cuerpo principal de la tabla debido a las dificultades para integrar un grupo en particular.
La posición del helio en la tabla periódica también exhibe inconvenientes. ¿Debería permanecer encabezando la familia de los gases nobles, tal como en la tabla tradicional, o, por el contrario, debería ser parte de la familia de los metales alcalinotérreos de acuerdo con su configuración electrónica? En los últimos tiempos, Scerri (2010, 2011) ha afirmado que el problema de la posición del hidrógeno y del helio tiene una solución correcta. Este autor propuso un nuevo criterio categorial para resolver la cuestión: la preservación o la creación de nuevas tríadas de elementos. Scerri recupera la idea de tríadas de elementos, propuesta por Johann Döbereiner en 1817, pero ahora con el número atómico en lugar del peso atómico. El resultado de la aplicación de este criterio es que el helio debe permanecer entre los gases nobles, dada la tríada “perfecta” de números atómicos He(2), Ne(10), Ar(18). A su vez, el hidrógeno se convierte en parte de los halógenos, de acuerdo con la tríada H(1), F(9), Cl(17). Sin embargo, el estatus epistemológico de las tríadas de elementos como criterio para resolver esta cuestión es actualmente motivo de controversia.
7.3 Los elementos en el grupo 3 ↑
Otro debate en curso es el que se centra en los elementos que deben integrar el grupo 3. Las tablas periódicas tradicionales incluyen los elementos escandio (21), itrio (39), lantano (57) y actinio (89). Sin embargo, algunos químicos y filósofos de la química consideran que los dos últimos elementos deben sustituirse por lutecio (71) y lawrencio (103). Esta modificación ha sido sugerida apelando tanto a sus propiedades físicas y químicas (Jensen 1982, 2015), como al enfoque de las tríadas de elementos, dada la tríada “perfecta” Y(39), Lu(71), Lw(103) (Scerri 2011). Esta propuesta se ha aplicado ya en muchos libros de texto y en nuevos diseños de tablas periódicas, aunque todavía se aprecia cierta resistencia a tal sustitución (Clark y White 2008, Lavelle 2008).
7.4 La reducción de la tabla periódica ↑
Dos son las perspectivas actuales sobre el problema de la reducción de la tabla periódica. La primera de ellas adopta un enfoque matemático que apela a los estudios periódicos de la similitud, la teoría de grupos y la teoría de la información. El resultado de estos estudios está comenzando a analizarse. El segundo enfoque se centra en la aplicación de la mecánica cuántica a la tabla periódica. Scerri (2012) señala que la teoría cuántica proporciona sólo una explicación parcial de la forma de la tabla periódica, ya que, si bien es posible predecir ciertas propiedades individuales de los elementos, no permite capturar propiedades globales tales como la pertenencia de los elementos a ciertos grupos y las relaciones entre ellos. La idea de las configuraciones electrónicas como responsables de las propiedades químicas de los elementos es casi un dogma que generaciones de estudiantes debe aprender. Sin embargo, Scerri hace hincapié en que este enfoque no es apropiado, por ejemplo, para decidir el lugar del hidrógeno y del helio o bien los elementos que pertenecen al grupo 3, como se ha señalado.
Por otra parte, el conjunto de los cuatro números cuánticos (n, l, m, s) predice que las capas atómicas pueden contener un máximo de 2, 8, 18 o 32 electrones, lo que está de acuerdo con la longitud de los períodos de la tabla. Sin embargo, la mecánica cuántica no justifica la repetición de las longitudes de los periodos, excepto el primero. En este sentido, es interesante destacar el debate actual sobre el estatus de la regla de Madelung, la cual brinda el orden de llenado de los orbitales de átomos en fase gaseosa, a saber:
¿Se ha derivado esta regla a partir de primeros principios (ab initio)? Si así fuera, habría un fuerte argumento para apoyar el punto de vista reduccionista. Pero mientras que algunos autores afirman que el objetivo se ha alcanzado, otros señalan que la regla de Madelung es sólo una regla semiempírica (Scerri 2012). El químico teórico Eugen Schwarz (2007) ha señalado que esta regla es relativamente poco importante en el mundo químico, ya que se diseñó para átomos neutros, libres y no unidos químicamente mientras que la atención debería dirigirse, por el contrario, a los átomos unidos.
8 Clases naturales en química ↑
La química es probablemente la disciplina paradigmática para estudiar clases naturales y al presente casi ha reemplazado a la biología en el estudio de este tema. En efecto, en la última década los debates se han centrado en el estudio de los elementos y compuestos químicos. La cuestión central en este contexto es: ¿son las clases naturales genuinamente naturales o meramente convencionales? En el contexto de la química, la pregunta sobre la existencia de las clases naturales ha estado estrechamente vinculada con la evaluación del microestructuralismo, la tesis según la cual las clases químicas pueden ser individuadas exclusivamente en términos de su microestructura (van Brakel 2000, Hendry 2008b, Needham 2011).
El debate sobre las clases naturales ha estado marcado por dos perspectivas: el convencionalismo y el esencialismo. Según el primero, las clases naturales son meras agrupaciones convencionales de particulares, es decir, responden a criterios puramente humanos que no implican un correlato natural. Los convencionalistas pueden aceptar que la ciencia emplea ciertas clases, pero conciben la elección particular como una mera decisión conveniente que depende de los propósitos particulares, y que puede ser reemplazada cuando las circunstancias cambian. Por su parte, el esencialismo concibe a las clases naturales como poseedoras de esencias, esto es, una propiedad o un conjunto de propiedades que las identifica como tales.
Mientras que el esencialismo fue una marca de la filosofía clásica, el convencionalismo se impuso durante el siglo XX a la luz del rechazo de la metafísica instaurado por el positivismo lógico del Círculo de Viena. No obstante, debido a algunas dificultades que enfrentó la perspectiva convencionalista, y también debido a la disminución de la influencia del positivismo lógico, el esencialismo experimentó un renacimiento durante los años ‘70 y los comienzos de los años ‘80, sobre todo en relación con las clases naturales. En la década de 1970, Kripke y Putnam desarrollaron una teoría de la referencia para los términos de clase natural, según la cual la referencia de los términos de clase está dada por propiedades esenciales descubiertas por la investigación científica.
Estos autores asumieron que la extensión del nombre de un elemento está determinada por su carga nuclear, en tanto propiedad microestructural descubierta por la ciencia. La esencia de todo aquello denotado por ‘oro’ es ser el elemento con número atómico 79. Un punto importante aquí es que la extensión de un término de clase está determinada por propiedades que los propios usuarios pueden ignorar. De hecho, antes del descubrimiento de la carga nuclear en las primeras décadas del siglo XX como criterio unívoco para identificar un elemento, los químicos fueron capaces de hacerlo por medio de las propiedades macroquímicas y las propiedades físicas, vale decir, sin conocer la estructura atómica. Sin embargo, según Kripke y Putnam, el descubrimiento del número atómico tiene prioridad explicativa: decir que ‘oro’ se refiere a la materia con número atómico 79 es el resultado de un descubrimiento empírico en lugar de una reconceptualización de la referencia del término.
La alternativa supuestamente dicotómica entre esencialismo y convencionalismo está anclada en el corazón de la química. De hecho, el ejemplo paradigmático en los argumentos de Kripke y Putnam es ‘agua es H2O’ o ‘agua = H2O’, un ejemplo acríticamente aceptado en general por la mayoría de los filósofos del lenguaje. El esencialismo en química toma así la forma de microstructuralismo. Este enfoque parece funcionar para los elementos químicos, ya que el número atómico es suficiente para identificar el elemento. Sin embargo, cuando el microstructuralismo se extiende de los elementos a los compuestos, las dificultades comienzan.
Un compuesto químico se identifica principalmente por sus elementos constitutivos. Por ejemplo, el metano (CH4) es aquel compuesto que consiste de un átomo de carbono y cuatro átomos de hidrógeno. Sin embargo, la identificación de un compuesto sólo por su composición está seriamente cuestionada por el fenómeno de isomería, descubierto por Woehler en 1827. Por ejemplo, el ácido fulmínico y el ácido ciánico comparten la misma fórmula molecular CHNO, pero sus diferentes propiedades químicas y físicas hacen de ellos diferentes sustancias. En consecuencia, la existencia de isómeros muestra que la fórmula molecular no es suficiente para clasificar elementos. La microestructura de los compuestos químicos se refiere no sólo a los átomos en las moléculas, sino también a su disposición espacial. Needham y van Brakel argumentan que compuestos como el agua pueden tener una estructura dinámica que no puede ser descrita adecuadamente por sus fórmulas de composición química; en otras palabras, el agua no puede ser considerada como un compuesto formado por una colección de moléculas de H2O. Hendry lleva el argumento un paso más allá cuando subraya que cualquier muestra de agua líquida, incluso pura, contiene no sólo moléculas de H2O sino también H3O+ e iones HO-.
En la misma dirección, Needham y van Brakel han argumentado, en contra de los argumentos de Kripke y Putnam, que es posible utilizar las propiedades macroscópicas (ej. el punto triple) para identificar sustancias sin necesidad de apelar a las esencias microestructurales. Esto sería suficiente para rechazar la afirmación según la cual las microdescripciones son necesarias para identificar las sustancias químicas. El concepto clásico de sustancia química, señala Needham, es, al igual que la temperatura, un concepto macroscópico cuyo sentido está determinado por criterios que descansan sobre la teoría macroscópica, principalmente la termodinámica.
9 Conclusiones y Perspectivas ↑
No mucho tiempo atrás la filosofía de la química seguía esperando reconocimiento como una legítima subdisciplina de la filosofía contemporánea de la ciencia. Como consecuencia de ello, en las reuniones académicas los filósofos de la química solían ser confinados a las sesiones de filosofía de la física. Esta situación se ha revertido casi completamente hoy. El creciente interés de los químicos, historiadores y filósofos de la ciencia en los problemas del mundo químico condujo a la filosofía de la química a ganar un fuerte impulso. Más allá de los temas tratados aquí, una amplia variedad de tópicos relacionados con la química son objeto de reflexión filosófica. Entre ellos se puede citar el estatus de las leyes y teorías químicas, modelos y explicaciones en química, el surgimiento de la química matemática, el problema de la visualización, la cuestión de la ética en química, así como temas metodológicos tales como experimentación, instrumentación y síntesis química. La nanotecnología es también un tema de creciente interés, en el que la química está particularmente involucrada (Schummer y Baird 2006). Por otra parte, en los últimos años las reflexiones filosóficas sobre la química han sido redescubiertas en obras clásicas de autores como Aristóteles, Kant, Hegel, Duhem, Bachelard y Cassirer, así como en renombrados químicos como Brodie, Ostwald, Polanyi, Wald, Caldin, Lavoisier, Paneth y Mendeleev, entre otros. Es de esperar, entonces, que esta amplia pluralidad de temáticas no sólo garantice el definitivo establecimiento social de la filosofía de la química, sino también una comprensión más profunda de una fascinante ciencia natural como la química.
10 Bibliografía ↑
Adúriz-Bravo, Agustín, Martín Labarca y Olimpia Lombardi. 2014. “Una noción de modelo útil para la formación del profesorado de química”. En Avances en Didáctica de la Química: Modelos y Lenguajes, editado por Cristian Merino, Agustín Adúriz-Bravo y Marcela Arellano, 37-49. Valparaíso: Pontificia Universidad Católica de Valparaíso.
Ball, Philip. 2011. “Beyond the bond”. Nature 469: 26-8.
Bishop, Robert. 2005. “Patching physics and chemistry together”. Philosophy of Science 72: 710-22.
Cerro, Mónica, y Gabriel Merino. 2009. “¿Moléculas sin esqueleto? La oportunidad perfecta para revisar el concepto de estructura molecular”. Educación Química XX: 187-91.
Clark, Roy W., y Gary D. White. 2008. “The flyleaf periodic table”. Journal of Chemical Education 4: 497.
Dirac, Paul. 1929. “Quantum mechanics of many-electron systems”. Proceedings of the Royal Society of London A 123: 714-33.
Earley, Joseph. 2009. “How elements shifts horizons: element, substance and the essential”. Foundations of Chemistry 11: 65-77.
Harris, Martha L. 2008. “Chemical reductionism revisited: Lewis, Pauling and physico-chemical nature of chemical bond”. Studies in History and Philosophy of Science 39: 78-90.
Hendry, Robin. 2005. “Lavoisier and Mendeleev on the elements”. Foundations of Chemistry 7: 31-48.
Hendry, Robin. 2006a. “Substantial confusion”. Studies in History and Philosophy of Science 37: 322-36.
Hendry, Robin. 2006b. “Elements, compounds and other chemical kinds”. Philosophy of Science 73: 864-75.
Hendry, Robin. 2008a. “Two conceptions of the chemical bond”. Philosophy of Science 75: 909-20.
Hendry, Robin. 2008b. “Microstructuralism: problems and prospects”. En Stuff – The Nature of Chemical Substances, editado por Klaus Ruthenberg y Jaap van Brakel, 107-121. Würzburg: Königshausen & Neumann.
Hendry, Robin. 2010. “Ontological reduction and molecular structure”. Studies in History and Philosophy of Modern Physics 41: 183-191.
Jensen, William. 1982. “The positions of Lanthanum (Actinium) and Lutetium (Lawrencium) in the periodic table”. Journal of Chemical Education 8: 634-36.
Jensen, William. 2015. “The positions of Lanthanum (Actinium) and Lutetium (Lawrencium) in the periodic table: an update”. Foundations of Chemistry 1: 23-31.
Katz, Gary. 2001. “The periodic table: an eight period table for the 21st centrury”. The Chemical Educator 6: 324-32.
Labarca, Martín. 2013. “Table talk”. Scientific American 7: 8-9.
Labarca, Martín, y Olimpia Lombardi. 2010. “Why orbitals do not exist?”. Foundations of Chemistry 12: 149-57.
Lavelle, Laurence. 2008. “Lanthanum (La) and Actinium (Ac) should remain in the d-block”. Journal of Chemical Education 85: 1482-83.
Leigh, G. Jeffrey. 2009. “Periodic Tables and IUPAC”. Chemistry International 31: 4-6.
Lombardi, Olimpia. 2013. “Acerca de qué nos habla la química? Nuevos argumentos a favor de la autonomía ontológica del mundo químico”. Revista Colombiana de Filosofía de la Ciencia 26: 105-44.
Lombardi, Olimpia, y Mario Castagnino. 2010. “Matters are not so clear on the physical side”. Foundations of Chemistry 12: 159-66.
Lombardi, Olimpia, y Martín Labarca. 2005. “The ontological autonomy of the chemical World”. Foundations of Chemistry 2: 125-48.
Lombardi, Olimpia, y Martín Labarca. 2006. “The ontological autonomy of the chemical world: A response to Needham”. Foundations of Chemistry 8: 81-92.
Lombardi, Olimpia, y Juan Camilo Martínez González. 2012. “Entre mecánica cuántica y estructuras químicas”. Scientiae Studia 10: 649-670.
Luisi, Pier L. 2002. “Emergence in chemistry: Chemistry as the embodiment of emergence”. Foundations of Chemistry 4: 183-200.
Manafu, Alexandru. 2012. “Internal realism and the problem of ontological autonomy: A critical note on Lombardi and Labarca”. Foundations of Chemistry 15: 225-28.
McIntyre, Lee. 2007. “The philosophy of chemistry: ten years later”. Synthese 155: 291-92.
Mulder, Peter. 2011. “Are orbitals observable?”. Hyle – International Journal for Philosophy of Chemistry 17: 24-35.
Needham, Paul. 2006a. “Ontological reduction: A comment on Lombardi-Labarca”. Foundations of Chemistry 8: 73-80.
Needham, Paul. 2006b. “Aristotle’s theory of chemical reaction and chemical substances”. En Philosophy of Chemistry. Synthesis of a New Discipline, editado por Davis Baird, Eric Scerri y Lee McIntyre, 43-67. Dordrecht: Springer.
Needham, Paul. 2011. “Microessentialism: What is the argument?”. Nous 45: 1-21.
Newman, Micah. 2008. “Chemical supervinience”. Foundations of Chemistry 10: 49-62.
Paneth, Friedrich A. 1931. “The epistemological status of the concept of element”, [reimpreso en Foundations of Chemistry 5: 113-45, 2003].
Primas, Hans. 1983. Chemistry, Quantum Mechanics and Reductionism. Berlin: Springer.
Psarros, Nikos. 1998. “What has philosophy to offer to chemistry?”. Foundations of Science 1: 183-202.
Ramsey, Jeffrey L. 1997. “Molecular shape, reduction, explanation and approximate concepts”. Synthese 111: 233-251.
Ruthenberg, Klaus. 2009. “Paneth, Kant and the philosophy of chemistry”. Foundations of Chemistry 11: 79-91.
Scerri, Eric R. 1994. “Has chemistry been at least approximately reduced to quantum mechanics?”. En Proceedings of the Philosophy of Science Association, editado por D. Hull, M. Forbes y R. Burian, 160-170. Chicago: Philosophy of Science Association, Volumen 1.
Scerri, Eric R. 2000a. “Have orbitals really been observed?”. Journal of Chemical Education 77: 1492-494.
Scerri, Eric R. 2000b. “Philosophy of chemistry – A new interdisciplinary field?”. Journal of Chemical Education 77: 522-26.
Scerri, Eric R. 2001. “The Recently Claimed Observation of Atomic Orbitals and Some Related Philosophical Issues”. Philosophy of Science 68: S76-S88.
Scerri, Eric R. 2005. “Editorial 20”, Foundations of Chemistry 7: 119-23.
Scerri, Eric R. 2006. “Normative and descriptive philosophy of science and the role of chemistry”. En Philosophy of Chemistry. Synthesis of a New Discipline, editado por Davis Baird, Eric Scerri y Lee McIntyre, 119-128. Dordrecht: Springer.
Scerri, Eric R. 2007. The Periodic Table – Its Story and Its Significance. New York: Oxford University Press.
Scerri, Eric R. 2010. “Explaining the periodic table, and the role of chemical triads”. Foundations of Chemistry 12: 69-83.
Scerri, Eric R. 2011. The Periodic Table. A Very Short Introduction. Oxford: Oxford University Press.
Scerri, Eric R. 2012. “What is an element? What is the periodic table? And what does quantum mechanics contribute to the question?”. Foundations of Chemistry 14: 69-81.
Scerri, Eric R. 2013. “Cracks in the Periodic Table”. Scientific American 6: 68-73.
Scerri, Eric R., y Lee McIntyre. 1997. “The case for the philosophy of chemistry”. Synthese 111: 213-32.
Schummer, Joachim. 2003. “The philosophy of chemistry”. Endeavour 1: 37-41.
Schummer, Joachim, y Davis Baird. eds. 2006. Nanotechnology Challenges: Implications for Philosophy, Ethics and Society. Singapore: World Scientific Publishing Co.
Schwarz, W. H. Eugen. 2007. “Recommended questions on the roads towards a scientific explanation of the periodic system of the chemical elements with the help of the concepts of quantum physics”. Foundations of Chemistry 9: 139-88.
Shaik, Sason S., y Philip Hiberty. 2008. A Chemist’s Guide to Valence Bond Theory. New York: Wiley.
Stemwedel, Janet. 2006. “Chemical bonds in causal explanations of chemical reactions”. Philosophy of Science Association Meeting 2006, Vancouver, B.C.
Stewart, Philip. 2005. “A new image of the periodic table”. Education in Chemistry 6: 156-58.
Tsimmerman, Valery. 2013. “Table talk”. Scientific American 7: 8-9.
van Brakel, Jaap. 1997. “Chemistry as the science of the transformation of substances”. Synthese 111: 253-82.
van Brakel, Jaap. 2000. Philosophy of Chemistry. Between the Manifest and the Scientific Image. Leuven: Leuven University Press.
van Brakel, Jaap. 2003. “The Ignis Fatuus of reduction and unification: back to the rough ground”. En Chemical Explanation: Characteristics, Development, Autonomy, editado por Joseph Earley, 30-43. New York: New York Academy of Sciences.
Vancik, Hrvoj. 1999. “Opus magnum: An outline for the philosophy of chemistry”. Foundations of Chemistry 1: 242-56.
Vemulapalli, G. Krishna, y Hans Byerly. 1999. “Remnants of reductionism”. Foundations of Chemistry 1: 17-41.
Vihalemm, Rein. 2011. “The autonomy of chemistry: old and new problems”. Foundations of Chemistry 13: 97-107.
Weininger, Steve. 1984. “The molecular structure conundrum: can classical chemistry be reduced to quantum chemistry?”. Journal of Chemical Education 61: 939-43.
Woolley, Guy. 1978. “Must a molecule have a structure?”. American Chemical Society 100: 1073-78.
Woolley, Guy. 1982. “Natural optical activity and the molecular hypothesis”. Structure and Bonding 52: 1-35.
11 Cómo Citar ↑
Labarca, Martín. 2016. "Filosofía de la química". En Diccionario Interdisciplinar Austral, editado por Claudia E. Vanney, Ignacio Silva y Juan F. Franck. URL=http://dia.austral.edu.ar/Filosofía_de_la_química
12 Derechos de autor ↑
DERECHOS RESERVADOS Diccionario Interdisciplinar Austral © Instituto de Filosofía - Universidad Austral - Claudia E. Vanney - 2016.
ISSN: 2524-941X
La representación del sistema periódico y de la ley periódica estrictamente en dos dimensiones. En sentido amplio, las nociones de ‘sistema periódico’ y ‘tabla periódica’ se emplean como sinónimos.