(→Derechos de autor) |
|||
| (No se muestran 2 ediciones intermedias del mismo usuario) | |||
| Línea 230: | Línea 230: | ||
[[File:Nueva imagen.png|left]] | [[File:Nueva imagen.png|left]] | ||
| − | |||
| − | |||
La urea fue el primer compuesto orgánico sintetizado a partir de dos moléculas inorgánicas, y también se ha detectado en el espacio interestelar. | La urea fue el primer compuesto orgánico sintetizado a partir de dos moléculas inorgánicas, y también se ha detectado en el espacio interestelar. | ||
| − | |||
| − | |||
El amoniaco es una de las principales fuentes de nitrógeno de los organismos vivos, y también está presente en otros planetas del sistema solar y en el espacio interestelar. | El amoniaco es una de las principales fuentes de nitrógeno de los organismos vivos, y también está presente en otros planetas del sistema solar y en el espacio interestelar. | ||
| − | |||
| − | |||
El metano es el compuesto de carbono más sencillo, y está presente en casi todos los planetas del sistema solar, en exoplanetas y en el espacio interestelar. | El metano es el compuesto de carbono más sencillo, y está presente en casi todos los planetas del sistema solar, en exoplanetas y en el espacio interestelar. | ||
| − | |||
| − | |||
| − | |||
{{Citar|url = http://dia.austral.edu.ar/Origen_de_la_vida|cabecera = Novo, Francisco J. 2015. "Origen de la vida"}} | {{Citar|url = http://dia.austral.edu.ar/Origen_de_la_vida|cabecera = Novo, Francisco J. 2015. "Origen de la vida"}} | ||
| Línea 252: | Línea 243: | ||
DERECHOS RESERVADOS Diccionario Interdisciplinar Austral © Instituto de Filosofía - Universidad Austral - Claudia E. Vanney - 2015. | DERECHOS RESERVADOS Diccionario Interdisciplinar Austral © Instituto de Filosofía - Universidad Austral - Claudia E. Vanney - 2015. | ||
| − | |||
| − | |||
| Línea 267: | Línea 256: | ||
El presente texto tiene su origen en un seminario pronunciado en el año 2012 en el grupo de investigación “Ciencia, Razón y Fe” (CRYF) de la Universidad de Navarra, y ha sido enriquecido con las reflexiones y discusiones mantenidas desde entonces con miembros de este grupo, en particular con el Prof. Javier Sánchez-Cañizares. El autor también agradece los comentarios y sugerencias de dos revisores anónimos. | El presente texto tiene su origen en un seminario pronunciado en el año 2012 en el grupo de investigación “Ciencia, Razón y Fe” (CRYF) de la Universidad de Navarra, y ha sido enriquecido con las reflexiones y discusiones mantenidas desde entonces con miembros de este grupo, en particular con el Prof. Javier Sánchez-Cañizares. El autor también agradece los comentarios y sugerencias de dos revisores anónimos. | ||
| − | |||
| − | |||
| − | |||
| − | |||
Revisión de 13:36 17 feb 2016
La aparición de la Vida en el Universo es uno de los grandes interrogantes que han preocupado a filósofos y científicos de todas las épocas. Aunque la especulación sobre este problema ha estado tradicionalmente lastrada por la dificultad de obtener evidencias experimentales, los últimos años han registrado importantes avances en campos variados como la química, la bioquímica, la astrobiología, la geología y la química de sistemas. Con los datos actuales, comienza a vislumbrarse un escenario plausible en el que pudiera haberse dado la transición desde sistemas químicos a organismos vivos.
Contenido
- 1 Planteamiento del problema
- 2 Génesis de las teorías sobre el origen de la vida
- 3 El mundo ARN (RNA-world)
- 4 El replicador
- 5 La membrana
- 6 El metabolismo
- 7 Cómo (y dónde) apareció el primer organismo “vivo”
- 8 Cuestiones abiertas
- 9 Bibliografía
- 10 Apéndice: Algunas moléculas importantes
- 11 Cómo Citar
- 12 Derechos de autor
- 13 Herramientas académicas
- 14 Agradecimientos
1 Planteamiento del problema ↑
La presencia de seres vivos es uno de los fenómenos más sorprendentes de todo el cosmos. Aunque la diferencia entre lo vivo y la materia inerte es clara, resulta difícil ofrecer una definición de vida que sea universalmente aceptada. En su prólogo al libro Origins of life: the central concepts publicado hace 20 años, Joyce propuso la clásica definición de ser vivo como un sistema químico auto-sostenido capaz de experimentar evolución darwiniana. Esta definición –no exenta de debate– exige dar una explicación satisfactoria sobre qué constituye un “sistema químico auto-sostenido” en condiciones tales que le permitan evolucionar. En torno a este problema existe en el ámbito científico un consenso bastante generalizado acerca de los rasgos que comparten todos los seres vivos, desde aquellos más complejos hasta las formas de vida más simples. En primer lugar, todo ser vivo debe poseer un sistema de transmisión de información, lo que entendemos por genética. Asimismo, debe poseer algún tipo de metabolismo que le permita obtener energía, bien a partir de la luz solar o bien utilizando nutrientes que incorpora desde el exterior. Finalmente, ha de estar delimitado por alguna barrera física o membrana que lo distinga del ambiente que le rodea, que permita mantener la homeostasis interna y a través de la cual el organismo intercambie nutrientes y sustancias de desecho con el exterior.
Finalmente, una característica muy importante que muestran todos los seres vivos es la capacidad de evolucionar, es decir, generar descendencia de la misma especie pero portadora de ciertas variaciones respecto a las generaciones precedentes. Esta evolución hace posible que esa población de individuos pueda adaptarse (y eventualmente sobrevivir) a condiciones ambientales muy cambiantes y en ocasiones tan agresivas que ponen en peligro la supervivencia de esa forma de vida. La propia estructura del material hereditario y el modo en que se transmite garantiza la introducción de variantes genéticas que hacen posible esta evolución.
Todos estos procesos (la formación de membranas, la copia y transmisión de material genético, las reacciones químicas que tienen lugar en el interior de las células) utilizan unos pocos tipos básicos de macromoléculas, generalmente bien conocidas: los ácidos nucleicos, las proteínas, los azúcares y los lípidos (ver el apéndice al final del capítulo para conocer algunos aspectos básicos de estas moléculas). Por tanto, cualquier intento de explicar cómo aparecieron los primeros seres vivos sobre la tierra debe comenzar por mostrar de modo satisfactorio cómo se dieron los procesos químicos necesarios para obtener todas estas macromoléculas a partir de elementos más sencillos. Tradicionalmente, los esfuerzos científicos en este campo se han dirigido a demostrar la plausibilidad de la formación espontánea en condiciones prebióticas de aminoácidos, nucleótidos, azúcares y lípidos. Dicha demostración no es tarea fácil porque para la síntesis de estas macromoléculas es necesaria la acción de catalizadores, sustancias que aceleran y facilitan las reacciones químicas. Así, aunque una reacción sea termodinámicamente improbable (porque requiere cierta cantidad de energía externa), los catalizadores ayudan a salvar esta barrera y facilitan que se lleve a cabo. Muchos de los catalizadores que conocemos hoy en día no estaban disponibles en la Tierra prebiótica y por tanto resulta difícil explicar que estas reacciones pudieran darse de modo espontáneo. De todas formas, este campo está experimentando grandes avances al haberse encontrado, para algunas de estas reacciones, catalizadores de origen orgánico (aminoácidos, por ejemplo) que sí existían en la Tierra prebiótica (Ricardo y Szostak 2009).
Aún después de haber demostrado vías plausibles para la síntesis prebiótica de macromoléculas, habrá que proponer un proceso mediante el cual todos esos componentes aislados llegaron a integrarse en una protocélula precursora de las primeras células vivas (conocida como progenote) que funcionaba ya como un organismo unitario. Esta integración es el paso más crucial para explicar el origen de la vida, pero quizás también el más difícil de desentrañar. Aunque todavía es mucho lo que desconocemos sobre el paso de la química a la biología, en años recientes se han dado grandes avances (Zimmer 2009; Service 2013).
Al margen de la discusión sobre la mayor o menor probabilidad de la aparición de seres vivos en condiciones prebióticas, la realidad es que sucedió. El sistema solar se originó hace 5.000 millones de años y la Tierra estaba formada hace 4.570 millones de años. El tiempo transcurrido desde entonces se divide en cuatro eones (Hadeico, Arcaico, Proterozoico y Fanerozoico). Resulta en cierto modo sorprendente que los seres vivos estuviesen ya presentes en la Tierra poco después de terminar el eón Hadeico, que transcurre desde la formación de planeta hasta hace 4.000 millones de años. Y resulta sorprendente porque en sus primeros mil millones de años de existencia la Tierra fue un lugar poco propicio para el florecimiento de seres vivos, debido a las altas temperaturas existentes y a una atmósfera todavía muy débil, incapaz de filtrar la radiación solar ultravioleta que resulta letal para muchas formas de vida. A todo esto hay que añadir el frecuente bombardeo de asteroides que culminó con un episodio particularmente intenso conocido como Late Heavy Bombardment (LHB), o Bombardeo Intenso Tardío. Esta lluvia de meteoritos tuvo lugar hace 4.000 millones de años coincidiendo con el final del eón Hadeico y el comienzo del eón Arcaico. Aunque el comienzo de la vida se suele situar hace 3.800 millones de años, el primer fósil claramente demostrado de un ser vivo es un organismo unicelular de 3.400 millones de años de antigüedad que probablemente obtenía energía a partir del azufre (Wacey y Cols 2011). Llama la atención, por tanto, que tan sólo 200 a 500 millones de años después del último bombardeo intenso de meteoritos ya existiesen seres vivos.
Aun así, resulta difícil de explicar la aparición del hipotético primer ser vivo ancestral a todos los existentes hoy en día (conocido como LUCA, siglas en inglés de Last Universal Common Ancestor), ya que se trataría de un organismo similar a las bacterias y por tanto con un grado bastante alto de complejidad, si tomamos como modelo el ser vivo más simple que conocemos en la actualidad (la bacteria Mycoplasma genitalium). El genoma de este organismo contiene 482 genes codificantes de proteínas, de los cuales sólo 387 parecen ser esenciales para la vida de una bacteria de características simples. Estudios teóricos sitúan en 206 el número mínimo de genes que son totalmente necesarios, pero aun así las proteínas codificadas por ese pequeño número de genes dan lugar a una intrincada red de interacciones de increíble complejidad. La pregunta que hemos de responder, por tanto, es cómo se alcanzó ese primer momento evolutivo.
2 Génesis de las teorías sobre el origen de la vida ↑
A principios del siglo XX se formuló la teoría conocida como abiogénesis, que propone la síntesis y ensamblaje de biomoléculas (para originar los primeros seres vivos) a partir de compuestos orgánicos más sencillos. El primer modelo teórico de abiogénesis fue propuesto independientemente por Alexander Oparin y J.B.S. Haldane, casi de modo simultáneo. Para Oparin, la vida se habría originado mediante la concentración local de compuestos prebióticos en unas estructuras que denominó "coacervados". En 1929, Haldane propuso otro modelo en que la aparición de la vida habría tenido lugar en un "caldo caliente diluido" (hot dilute soup) en los océanos primitivos. Ambas propuestas, que en su momento no pasaban de ser ideas altamente especulativas, tuvieron una gran influencia en las teorías acerca del origen de la vida, así como en la experimentación desarrollada sobre este tema en las décadas siguientes.
Los primeros intentos experimentales de mostrar la plausibilidad de la abiogénesis se deben a Stanley Miller y Harold Urey en 1953. Ya Oparin había conjeturado que la atmósfera de la Tierra primitiva tuvo que ser reductora, con una composición de 60% hidrógeno, 20% oxígeno (en forma de vapor de agua), 10% de CO2, 5-7% de sulfhídrico y pequeñas cantidades de nitrógeno, monóxido de carbono, hidrógeno libre, metano y gases inertes. El CO2 disuelto en el agua habría llevado a que el mar fuese ligeramente ácido, con un pH en torno a 5,5. A partir de 1953, Miller y Urey realizaron experimentos simulando estas condiciones en el laboratorio (el experimento está muy bien explicado en un video al que se puede acceder consultando los enlaces al final de esta entrada). Al hacer recircular una mezcla de vapor de agua, CO2, amoniaco (NH3), metano (CH4), nitrógeno e hidrógeno a temperaturas altas y sometiéndola a chispazos eléctricos repetidos, con el tiempo aparecían en la mezcla algunos aminoácidos, azúcares y otras moléculas orgánicas más o menos complejas (urea, formaldehído, ácido cianhídrico, ácido acético). Esto demostraba que estos compuestos, los “ladrillos” que constituyen las macromoléculas esenciales para la vida, se podrían haber originado en la Tierra primitiva mediante procesos puramente físico-químicos.
Sin embargo, a partir de los años 60 se cuestionó la validez del modelo de atmósfera reductora con abundancia de hidrógeno; actualmente parece que los científicos se inclinan más por un escenario en el que la atmósfera inicial sería más rica en CO2, aunque todavía tendría una cantidad considerable de hidrógeno (30% del total de gases atmosféricos). Una buena fuente de información en este sentido son las condritas, rocas que proceden del material original del sistema solar que dio lugar a los planetas y asteroides. Se ha visto que estas rocas, en condiciones de altas temperaturas y presiones como las que se dan durante la formación de planetas, dejan escapar gases. Los cálculos sobre la composición de esos gases muestran que son ricos en hidrógeno, metano y amoniaco.
De todas formas, la síntesis prebiótica de aminoácidos también sería posible aunque la atmósfera de Tierra primitiva hubiese sido más neutra que reductora. Esto se sabe porque un grupo de investigadores obtuvo cantidades significativas de aminoácidos a partir de mezclas gaseosas neutras en presencia de carbonato cálcico (abundante en rocas) y de iones ferrosos (abundantes en la Tierra primitiva). Estos mismos científicos analizaron en el año 2008 once viales que se habían conservado de los experimentos originales de Miller, utilizando técnicas más modernas y sensibles de las que entonces estaban disponibles (Johnson y cols. 2008). Para su sorpresa, encontraron que uno de los viales contenía el mayor número de moléculas orgánicas diferentes de todos los experimentos realizados por Miller: 22 aminoácidos, 5 aminas y muchas moléculas hidroxiladas. Dicho vial correspondía precisamente a un experimento realizado a un pH más neutro que el de la atmósfera reductora, pues trataba de reproducir las supuestas condiciones que se darían en la cercanía de volcanes.
Los experimentos de Miller-Urey demostraron que fue posible, al menos, la síntesis prebiótica de aminoácidos y otras moléculas importantes para el origen de los seres vivos (Bada 2013). A pesar del conocimiento generado por estos experimentos, durante mucho tiempo han persistido grandes lagunas en torno a los procesos químicos fundamentales que podrían dar apoyo a la abiogénesis, especialmente en lo que se refiere a la aparición de ácidos nucleicos, la aparición del código genético y de las proteínas, o el tipo de simetría que comparten todos los aminoácidos y azúcares presentes en la Tierra. Sin embargo, los avances experimentales realizados en las últimas décadas en todos estos campos hacen que hoy en día no sea descabellado proponer un origen de los primeros seres vivos a partir de materia orgánica no viva, si bien el cuadro todavía está incompleto.
Por ejemplo, uno de los obstáculos que parecían insalvables hasta hace pocas décadas era la aparición de las proteínas. Existe un acuerdo bastante unánime en que las proteínas no pueden haber sido las primeras biomoléculas en aparecer, ya que se requiere un ácido nucleico, un código genético y una maquinaria de traducción para poder formar proteínas funcionales a base de unir aminoácidos individuales en una secuencia concreta. Dicho de otro modo, para fabricar ácidos nucleicos la célula necesita proteínas, pero para poder formar proteínas a partir de aminoácidos individuales es imprescindible la presencia previa de un ácido nucleico. Esto supone un problema porque el ácido nucleico no podría haber existido sin la presencia de proteínas, pero a su vez no podría haber proteínas sin un ácido nucleico que las codificase. Es evidente que un sistema tan complejo como la transcripción de ADN a ARN y la traducción del ARN a proteína deben haber sido posteriores al comienzo de los seres vivos, que en sus inicios habrían poseído un sistema más sencillo (y probablemente precursor del que actualmente usan todos los organismos). Este enigma supuso durante muchos años un problema para las teorías abiogénicas, porque tanto la síntesis de nucleótidos individuales como su polimerización (la unión de varios nucleótidos seguidos para formar cadenas más o menos largas) requieren la existencia de proteínas que catalicen esas reacciones. Una teoría muy aceptada por los científicos en las últimas décadas, que podría resolver esta dificultad, es que ese hipotético sistema primitivo de transmisión de información no estaba basado en ADN, sino en el otro tipo de ácido nucleico conocido como ARN (RNA en inglés). A continuación me centraré brevemente en la explicación de esta hipótesis.
3 El mundo ARN (RNA-world) ↑
Un descubrimiento crucial en el estudio del origen de la vida fueron las ribozimas. Thomas Cech, estudiando el organismo unicelular Tetrahymena, encontró pequeñas moléculas de ARN que poseían actividad catalítica, es decir, favorecían algunas reacciones químicas. Hasta ese momento se pensaba que esta función de “catalizador” sólo la podían llevar a cabo proteínas, de ahí la sorpresa que supuso este descubrimiento. Se vio, por ejemplo, que algunos intrones del genoma de este organismo (los intrones son regiones de un gen que no se utilizan para fabricar proteínas, por lo que la células los excluye del ARN mensajero) tienen la propiedad de catalizar su propio corte de la molécula original de ARN. Lógicamente, el descubrimiento de que una misma molécula puede llevar a cabo simultáneamente dos de las funciones necesarias para constituir un ser vivo (transmitir información genética y catalizar reacciones químicas) tuvo un enorme impacto en la investigación sobre el origen de la vida, y llevó a formular la hipótesis de un "mundo ARN" (RNA-world hypothesis) en el cual las primeras protocélulas constarían únicamente de un pequeño número de moléculas de ARN similares a ribozimas (Cech 2012). En años posteriores, se ha comprobado que otro tipo de ARN que está presente en todas las células (en concreto en sus ribosomas, las estructuras en las que el ARN mensajero es traducido a proteína) también tiene un núcleo capaz de favorecer reacciones químicas sin la ayuda de proteínas. De hecho, algunos ARN de los ribosomas y otros ARN arcaicos están presentes en organismos pertenecientes a los tres dominios de seres vivos que habitan el planeta, lo que indica su gran antigüedad. Es precisamente la distribución universal de estas moléculas de ARN por todos los dominios de la vida lo que apoya la hipótesis de que el ancestro común a todos ellos (LUCA) poseía moléculas similares basadas en un ARN con capacidad catalítica.
Como suele ser habitual en ciencia, la hipótesis RNA-world se presenta en varias versiones. Una de ellas sostiene que el ácido nucleico de los primeros seres vivos no sería realmente un ARN, sino algún tipo de "pre-ARN" en el que el azúcar (la ribosa) estaría sustituido por otras moléculas similares desde el punto de vista químico. Se han propuesto, por ejemplo, la treosa (que daría TNA en vez de RNA, siempre utilizando las siglas en inglés) o el glicol (GNA). En conjunto, estos hipotéticos ácidos nucleicos se conocen como XNA (donde la X se sustituye por el compuesto oportuno). En este sentido son de gran interés los resultados obtenidos recientemente con algunas polimerasas, las proteínas que se encargan de alargar las cadenas de ADN o ARN uniendo nuevos nucleótidos. Al someterlas a evolución artificial en el laboratorio, algunas de estas polimerasas adquieren la capacidad de incorporar a la nueva cadena no sólo los nucleótidos naturales, sino también alguno de estos XNAs sintéticos. En el año 2014, un grupo de investigadores utilizó dos nucleótidos (llamados d5SICS y dNaM) y crearon un fragmento de ADN que lleva una pareja formada por estos dos nucleótidos (Malyshev y cols 2014). Al introducir ese fragmento de ADN en una bacteria, ésta copió todo el fragmento sin eliminar los nucleótidos extraños durante 10 ciclos de división bacteriana. Muchos de estos nucleótidos artificiales son resistentes a la degradación y podrían haber jugado un papel como precursores de los ácidos nucleicos que conocemos hoy en día, aunque éste es un tema todavía sujeto a especulación.
4 El replicador ↑
De todas formas, en cualquiera de los escenarios que se propongan el problema fundamental a explicar es la aparición de las primeras moléculas lineales de ARN formadas por decenas o cientos de ribonucleótidos unidos unos a otros en una larga cadena. Cualquier explicación convincente de la síntesis espontánea de una cadena relativamente simple de ARN (un oligo-ribonucleótido) exige dos cosas: primero, demostrar que es posible la síntesis de ribonucleótidos (los monómeros) en ausencia de catalizadores; en segundo lugar, demostrar que se puede dar la polimerización (la unión de monómeros para formar cadenas más largas) en condiciones prebióticas sin la intervención de las proteínas que actualmente hacen posible esta reacción en las células (conocidas como polimerasas y ligasas).
Respecto a lo primero (la síntesis de ribonucleótidos) el camino tradicional ha sido dividir el problema en dos partes: por un lado, la síntesis del azúcar que forma parte de los nucleótidos, que en el caso del ARN es la ribosa; en segundo lugar, la síntesis de las nucleobases (adenina, citosina, guanina o timina, ver el apéndice al final de esta entrada). La síntesis de azúcares en condiciones prebióticas no ofrece excesivos problemas, ya que se conoce desde hace tiempo una reacción química mediante la cual se condensan dos moléculas de formaldehído para dar glicolaldehído y, tras varias reacciones, se forman pentosas (azúcares con cinco carbonos, como la ribosa). Dichas reacciones se ven estimuladas en presencia de algunos minerales como el boro (que se piensa era abundante en la Tierra primitiva) y también en presencia de moléculas orgánicas simples como aminoácidos, péptidos pequeños (de dos a cinco aminoácidos) y tetrazoles de aminoácidos, que pueden catalizar reacciones de este tipo incluso en soluciones acuosas.
Por lo que respecta a la formación de nucleobases, algunas aparecían ya en los experimentos de Miller, pero desde un principio se vio que la síntesis de nucleótidos completos (es decir, la nucleobase unida a un azúcar y a los grupos fosfato) es mucho más difícil. De hecho, nunca se ha conseguido condensar la ribosa con una nucleobase en condiciones prebióticas. Sin embargo, este panorama cambió radicalmente en el año 2009, cuando investigadores británicos demostraron la síntesis de ribonucleótidos de pirimidinas (incluso en su forma activada) de modo espontáneo a partir de moléculas prebióticas sencillas como cianamida, glicolaldehído, gliceraldehído y cianoacetileno (Powner y cols. 2009). Esta nueva vía de síntesis evita así el paso de condensación del azúcar con la nucleobase, que de forma espontánea había sido imposible de obtener. Además, no requiere la utilización de catalizadores, lo cual la convierte en un candidato ideal para las condiciones de la Tierra prebiótica.
El segundo punto a demostrar sería la polimerización de ribonucleótidos en cadenas más o menos largas que pudiesen dar lugar a una ribozima. Inicialmente este proceso debería haber sido espontáneo y puramente químico, mediante la simple concatenación de monómeros, para más adelante formar ribozimas que tuviesen ellas mismas una cierta actividad polimerasa y/o ligasa. Pero la concatenación espontánea de monómeros no es nada simple, pues la unión de ribonucleótidos es muy ineficaz en soluciones acuosas (como las que tendrían lugar en los océanos primitivos). Además, dicha unión requiere la activación de los grupos fosfato de los correspondientes monómeros para que se puedan formar los enlaces 3'-5'. Actualmente hay dos líneas de evidencia que muestran cómo se podría superar esta dificultad. Por un lado, trabajos muy recientes han encontrado fosfitos en rocas anteriores a los 3.500 millones de años, lo cual sugiere que el océano primitivo del eón Arcaico tenía cantidades significativas de fósforo reactivo que facilitaría la unión de dos nucleótidos (Pasek y cols. 2013). Por otro lado, los ribonucleótidos que se obtienen por la nueva ruta de síntesis mencionada en el apartado anterior ya están en su forma “activada”, por lo que esto no sería un obstáculo insalvable.
De modo adicional, diversos experimentos han demostrado que la polimerización de ribonucleótidos se ve favorecida cuando tiene lugar en la superficie de algunas arcillas, en concreto un tipo especial de arcilla llamado montmorillonita. Sobre la superficie de estas arcillas se han obtenido oligómeros (pequeñas cadenas) de ARN de hasta 50 unidades, con preferencia por enlaces 3’-5’ tal y como existen en el ARN natural. En esta misma línea, se ha observado que algunas superficies metálicas y membranas lipídicas también favorecen la polimerización de nucleótidos, cuando tiene lugar en presencia de moléculas cofactoras (Yang y cols. 2013).
Recientemente el laboratorio de Jack Szostak ha demostrado la polimerización no-enzimática de cadenas de ARN dentro de vesículas lipídicas que están sometidas a ciclos de calor-frío como los que podrían darse entre la parte caliente y la parte fría de una laguna volcánica o fuente hidrotermal. Sería un proceso en cierto modo similar a la reacción en cadena de la polimerasa (PCR) que se utiliza en los laboratorios de biología molecular para amplificar un fragmento de ADN: ciclos de frío y calor que se suceden alternativamente, de modo que en la fase de alta temperatura se separan las dos hebras de una doble hélice mientras que durante la fase fría se van uniendo nucleótidos libres copiando cada una de las hebras originales. En el caso de una vesícula que se mueve en una fuente hidrotermal, la parte “fría” de la corriente favorecería la incorporación de nucleótidos a la vesícula de forma que estos monómeros se unen sobre una cadena molde y originan una nueva cadena de ARN complementaria a la original. En la parte “caliente”, las dos hebras (la molde original y la que se ha formado sobre ella) se separarían al superarse la temperatura de fusión que las mantiene unidas. Tales ciclos serían bastante plausibles en condiciones prebióticas y no requieren la presencia de proteínas catalizadoras, aunque presuponen la presencia de cadenas de ARN dentro de las vesículas.
Este proceso es lento y sujeto a muchos errores, por lo que con el tiempo debería ser remplazado por ribozimas que posean ya la propiedad de catalizar su propia replicación (o de sintetizar otras ribozimas) sin la ayuda de proteínas con actividad polimerasa o ligasa. Presumiblemente, las cadenas de ARN primitivas se plegarían dando ribozimas con actividades catalíticas diversas, actividades que se irían seleccionando en virtud de la utilidad que tuviesen para el progenote primitivo. Varios descubrimientos de los últimos cinco años sugieren el modo en que esto pudo suceder. Por ejemplo, mediante técnicas de evolución dirigida se ha logrado obtener una pareja de dos ribozimas que son capaces de replicarse mutuamente, partiendo de la fusión de cuatro pequeñas cadenas de ARN (Lincoln y Joyce 2009). Estas dos ribozimas pueden llegar a duplicar el número total de moléculas presentes en el tubo de ensayo cada sesenta minutos, de forma prácticamente ilimitada. Otros investigadores han logrado crear ribozimas capaces de sintetizar moléculas de ARN diferentes a sí mismas de hasta 95 nucleótidos de longitud (Wochner y cols 2011), y más recientemente han obtenido en el laboratorio una ribozima capaz de replicar hasta 206 nucleótidos (más que su propia longitud) a bajas temperaturas (Attwater y cols. 2013).
Suponiendo que todos estos procesos tuvieron éxito, con el tiempo aparecería una molécula de ARN capaz de copiarse a sí misma, es decir, una ribozima autocatalítica. Esto habría hecho posible el inicio de mecanismos evolutivos, ya que la fidelidad de copia no habría sido muy alta y por tanto se generarían moléculas con pequeñas diferencias respecto a la original. La inmensa mayoría de estas moléculas mutantes serían inactivas, pero una pequeña minoría podría funcionar con mayor eficiencia o incluso adoptar nuevas actividades catalíticas para favorecer la síntesis de nucleótidos en el interior de la protocélula. Como hemos visto, algunos estudios experimentales han logrado hacer evolucionar una ribozima que tenía actividad ligasa de ARN (unía un solo nucleótido cada vez) hasta lograr que adquiera actividad polimerasa (uniendo varios nucleótidos seguidos en cadena) y así sintetizar ribozimas de su misma longitud o incluso mayores. Asimismo, se han obtenido parejas de ribozimas capaces de sintetizarse mutuamente la una a la otra a partir de fragmentos más pequeños. Tales reacciones podrían complicarse añadiendo nuevos componentes, hasta formar conjuntos de moléculas auto-replicativas que se catalizan mutuamente en forma de ciclos cerrados. Una vez que estos ciclos de reacciones están en marcha, algunas ribozimas podrían adquirir la propiedad de catalizar preferentemente otras reacciones, y ese conjunto de ARNs obtendría una ventaja evolutiva evidente sobre aquellos que simplemente son capaces de copiarse a sí mismos. Todo esto permite proponer un escenario en el que se iría dando una acumulación progresiva de moléculas de ARN organizadas en redes autocatalíticas que generarían ribozimas más largas, las cuales a su vez mejorarían progresivamente las reacciones de polimerización hasta generar una ribozima con actividad polimerasa de tipo “general” (o sea, capaz de catalizar la síntesis de cualquier cadena de ARN).
El siguiente paso debería haber sido, probablemente, la unión de los distintos ARN catalíticos en una misma cadena, dando lugar al primer genoma: un protogenoma de ARN. La ventaja de tener todos estos primitivos genes juntos en una misma molécula reside en que pasarían juntos “en bloque" a cada una de las células de la progenie cuando la protocélula se divide, evitando la pérdida indiscriminada de genes en cada división. Además, esta disposición permitiría sincronizar el proceso de replicación (copia) de modo que todos se copiarían simultáneamente utilizando una sola maquinaria molecular. Este protogenoma de ARN habría sido finalmente sustituido por ADN (probablemente mediante desoxidación de la ribosa a 2-desoxi-ribosa, el azúcar que forma el ADN), debido a las ventajas evidentes de estabilidad que muestra el ADN sobre el ARN.
Finalmente, habría que explicar la aparición de las 200 proteínas que son necesarias para el funcionamiento de una célula elemental, junto con el mecanismo de traducción proteica. La célula primitiva tendría inicialmente una gran dependencia del medio externo, ya que su metabolismo sería muy simple y la membrana sería mucho menos selectiva que la membrana de las células actuales. Esto le permitiría obtener aminoácidos individuales del medio externo sin tener que sintetizarlos en su interior. Como ya hemos comentado, recientemente se ha observado que los aminoácidos se pueden comportar como catalizadores (organocatalizadores) y estimular la actividad de las ribozimas; quizás haya sido éste el paso inicial en la evolución del sistema de traducción de proteínas. Diversos estudios teóricos han mostrado los pasos intermedios que serían necesarios para completar este proceso, así como la evolución gradual del ribosoma a partir del núcleo catalítico inicial presente en la molécula de ARN que forma estas estructuras.
5 La membrana ↑
Por lo que respecta a la membrana lipídica de las primeras protocélulas, lo más probable es que inicialmente estuviese formada por ácidos grasos más sencillos que los fosfolípidos que forman las membranas actuales (ver apéndice). Si las membranas modernas son bicapas de fosfolípidos de glicerol, las membranas primitivas probablemente estarían constituidas por moléculas más sencillas, de cadena única, también de carácter anfifílico (con una parte soluble y otra insoluble en agua), tales como ácidos o alcoholes monocarboxílicos. El origen de estos compuestos podría ser múltiple. Por un lado, se ha visto que son muy abundantes en meteoritos del tipo de las condritas carbonáceas, por lo que podrían haber llegado a la Tierra ya formados desde el espacio exterior. Pero también cabe la posibilidad de que se hayan formado abióticamente en la Tierra primitiva mediante la reacción de CO e hidrógeno para dar lugar a diversos hidrocarburos, reacción que sería viable a altas temperaturas en la presencia de catalizadores férricos, sobre la superficie de arcillas de montmorillonita y también en condiciones hidrotermales. Independientemente del origen, el resultado sería la presencia de ácidos grasos inicialmente muy diluidos en una solución acuosa, pero que serían concentrados por sucesivos ciclos de evaporación, o bien mediante la formación de pequeñas gotas aerosolizadas que además trasladarían esas vesículas a puntos distantes del lugar donde se formaron.
Se ha comprobado que estos ácidos grasos tienen la capacidad de formar espontáneamente micelas, vesículas esféricas rodeadas por una capa simple o doble, o incluso con múltiples capas (Ricardo y Szostak 2009). Lógicamente, esas protomembranas tendrían propiedades mucho menos sofisticadas que las membranas de las células actuales. Inicialmente funcionarían como una simple barrera que dejaría entrar moléculas pequeñas desde el exterior e impediría la salida de macromoléculas vitales para el funcionamiento del progenote. Diversos laboratorios han demostrado que vesículas de este tipo pueden incluso crecer y dividirse mediante mecanismos puramente físico-químicos: cuando incorporan nuevos ácidos grasos al contenido de las membranas, éstas aumentan progresivamente de tamaño hasta formar vesículas alargadas que pueden dividirse en micelas "hijas" más pequeñas mediante fuerzas físicas débiles, como una ligera agitación. Incluso se han obtenido membranas autocatalíticas que crecen indefinidamente (Hardy y cols. 2015).
Dada la sorprendente estabilidad térmica de estas vesículas, es factible que pudiesen resistir temperaturas de hasta 100° C sin romperse, lo que aporta una base teórica a los ciclos térmicos de los que hemos hablado anteriormente (ciclos que explicaban la separación de la hebra molde y la hebra recién sintetizada durante la polimerización de los ARN en el interior de las vesículas). De hecho, también se ha comprobado que las altas temperaturas favorecen el paso de ribonucleótidos a través de estas membranas, lo cual aumentaría la concentración de ribonucleótidos en el interior de la vesícula y haría posible la síntesis de nuevas copias del ácido nucleico al bajar la temperatura. Estos ciclos de calor-frío podrían haberse dado en chimeneas hidrotermales o en fuentes termales cercanas a volcanes.
6 El metabolismo ↑
Desde los años 80 del siglo XX diversos científicos han sugerido que, de los elementos que constituyen un ser vivo, el primero en aparecer sobre la Tierra debería haber sido el metabolismo, un conjunto mínimo de reacciones químicas esenciales que darían soporte energético a las primeras protocélulas (Dyson 1982). En 1990, un científico llamado Günter Wächtershäuser propuso que el origen de la vida sería más plausible bajo un escenario "metabolism-first" (denominado por él “pioneer organism theory”). Según esta hipótesis, algunos ciclos metabólicos relativamente complejos se habrían ensamblado de modo independiente a los sistemas genéticos, aportando la energía y algunos sustratos imprescindibles para la aparición de los sistemas de polimerización de los ARN primitivos (Wächtershäuser 1990). La aparición de la vida habría sido un proceso "plano", iniciado por un sistema metabólico bidimensional sobre la superficie de las chimeneas hidrotermales ácidas también llamadas fumarolas negras, en cuyos poros (a altas temperaturas y presiones) se habrían concentrado estos procesos como si estuviesen en el interior de vesículas. Para el funcionamiento de estas reacciones es imprescindible la presencia de metales como hierro y níquel. Un aspecto central de esta hipótesis es el ciclo reductivo del ácido cítrico (o ciclo de Krebs inverso), que genera un buen número de biomoléculas a partir de CO2, CO, ácido sulfhídrico y ácido cianhídrico. Este ciclo es usado actualmente por algunas bacterias para obtener compuestos complejos de carbono a partir de CO2 y agua.
Aunque el escenario "metabolism-first" no ha gozado de tanta popularidad como el “RNA-first”, no deja de ser razonablemente plausible y cada vez hay más estudios que lo respaldan. Por ejemplo, en años recientes se ha visto que partículas de sulfuro de cinc, bajo la influencia de la luz ultravioleta, pueden catalizar tres de los cinco pasos reductores del ciclo de Krebs inverso. Quizás combinaciones de otros metales puedan catalizar los restantes pasos reductores de este ciclo. Por otro lado, el estudio de otro tipo de fuentes hidrotermales (las fumarolas blancas, con efluentes más alcalinos y a menor temperatura que las fumarolas negras) ha revelado la presencia de reacciones geoquímicas que producen energía en condiciones anaeróbicas, y que guardan un gran parecido con la fisiología de ciertas bacterias y arqueas anaeróbicas que utilizan acetato o metano para obtener energía. La semejanza de estos sistemas químicos con reacciones presentes en seres vivos tan antiguos abre un interesante campo de investigación sobre el origen de la vida.
7 Cómo (y dónde) apareció el primer organismo “vivo” ↑
Como hemos visto, los conceptos de auto-catálisis y auto-replicación, entendidos de modo general como la capacidad de sustentar el propio funcionamiento y de generar copias de sí mismo, son fundamentales para explicar la aparición de cualquier sistema vivo: es necesario generar copias del sistema genético de transmisión de información, reproducir la membrana que lo separa del medio y mantener las redes metabólicas que le proporcionan energía. Una vez que estos tres elementos coexistieron de modo sostenible en una protocélula, ésta poseía ya las características básicas que le permitieron reproducirse introduciendo al mismo tiempo modificaciones en la descendencia, lo que puso en marcha los procesos evolutivos que llevaron a mejorar progresivamente el sistema y a introducir las sofisticaciones necesarias para que la vida, tal y como la entendemos, pudiese arraigar definitivamente.
Este proceso se presenta como extremadamente complejo y laborioso, de ahí que la aparición de seres vivos “tan pronto”, habiendo transcurrido poco tiempo desde la formación de la Tierra, resulte en cierto modo sorprendente. De hecho, diversos autores han llegado a sugerir que la génesis de los primeros organismos se vio acelerada por la llegada de material extraterrestre en los asteroides del Late Heavy Bombardment. Según la versión fuerte de esta hipótesis, conocida como panspermia, dicho material contendría seres vivos capaces de sobrevivir en las condiciones extremas a las que se habrían visto sometidos durante su llegada a la Tierra. La versión molecular de la panspermia propone que los meteoritos trajeron todos o algunos de los compuestos necesarios para la aparición de la vida. Sobre todo en esta última versión molecular, esta hipótesis encuentra respaldo en el hecho de que algunos meteoritos contienen gran cantidad de compuestos orgánicos relativamente complejos, como aminoácidos o azúcares. Por ejemplo, uno de los más conocidos, el meteorito Murchison que cayó en Australia en 1969, contiene más de 50 aminoácidos distintos, además de polialcoholes (precursores de azúcares), hidrocarburos, ácidos carboxílicos, y algunas nucleobases (uracilo y xantina) (Cronin y Chang 1993; Martins y cols 2008).
Además, en otros planetas del sistema solar, así como en exoplanetas o incluso en sistemas estelares lejanos se ha detectado la presencia de compuestos orgánicos prebióticos de interés para el origen de la vida, como formaldehído, glicolaldehído, urea, amoníaco o metano (ver apéndice con la estructura de algunas de estas moléculas). Por ejemplo, en 2012 astrónomos daneses encontraron glicolaldehído en un sistema estelar que se encuentra situado a 400 años luz de la Tierra (Jorgensen y cols 2012), y más recientemente se han encontrado cantidades relativamente altas de cianuros y formamida en regiones donde se están formando estrellas similares a nuestro sol (López-Sepulcre y cols. 2015; Öberg y cols. 2015). Todo ello demuestra que algunas moléculas orgánicas complejas procedentes del espacio exterior podrían haber participado en el origen de la vida en la Tierra.
Sea como fuere, la pregunta que queda por responder es cómo todas las piezas se ensamblaron en un momento dado para originar un organismo vivo. Tradicionalmente se ha explicado este proceso de manera secuencial: los primeros organismos vivos se habrían ido construyendo poco a poco, primero uno de los elementos (el replicador o el metabolismo, según las teorías), después ese elemento quedaría rodeado y asilado por una membrana, a continuación se incorporaría el otro elemento al sistema y finalmente todos ellos pasarían a interaccionar y funcionar como un todo auto-sostenido. Sin embargo, tal modelo es probablemente demasiado simplista. Por eso, las propuestas científicas más recientes en este sentido proponen escenarios más heterogéneos y complejos en los que todos estos ingredientes irían apareciendo simultáneamente. Por ejemplo, se ha propuesto una vía química en la cual se forman precursores de ribonucleótidos, de aminoácidos y de lípidos a partir de ácido cianhídrico y algunos de sus derivados, en presencia de luz ultravioleta (Patel y cols 2015). En otro estudio, la irradiación de formamida con protones de alta energía en presencia de polvo procedente de meteoritos produjo una gran variedad de compuestos importantes para la química prebiótica, como aminoácidos, ácidos carboxílicos, azúcares, nucleobases e incluso los cuatro nucleósidos (Saladino y cols. 2015). Estos experimentos permiten pensar en una “química común” que explicaría la aparición simultánea de todos los sistemas moleculares necesarios para constituir una protocélula. En un momento dado, en condiciones quizás excepcionales, las distintas especies moleculares habrían coexistido a altas concentraciones dentro de un sistema relativamente aislado del medio exterior, momento en que se habría visto favorecido el proceso de integración.
Todo esto, lógicamente, lleva de la mano a la pregunta sobre cuál podría haber sido la localización más probable donde tuvo lugar el ensamblaje del primer sistema aislado auto-sostenido. Una de las hipótesis más populares entre los expertos apunta a las fuentes hidrotermales que se abren en la profundidad del océano o a las chimeneas volcánicas terrestres (Martin 2014). En las fuentes hidrotermales del fondo marino, el agua de mar se filtra por las fisuras de la corteza oceánica (la parte de la corteza terrestre que constituye el fondo marino). Esto hace posible que el agua entre en contacto con el magma y salga por las fuentes hidrotermales tras haber alcanzado altas temperaturas (en torno a 350 ºC), bajo las altas presiones existentes en esas profundidades. Al contacto con el agua de mar casi congelada, los minerales presentes en el líquido precipitan y originan las típicas chimeneas, que pueden llegar a alcanzar varios metros de altura. Como hemos visto anteriormente, una característica muy atractiva de estas chimeneas es que contienen ambientes minerales microporosos que son semipermeables, es decir, dejan pasar a su través moléculas de ciertos tamaños pero no de otros. En estos pequeños microporos, de dimensiones similares a las de una célula, se podrían concentrar ciertas moléculas o ciclos metabólicos, por lo que podrían jugar un papel similar a las membranas y servir de alternativa a las primeras protocélulas. Ya hemos visto que las fuentes hidrotermales, tanto las fumarolas negras de ambiente ácido como las fumarolas blancas de condiciones más alcalinas y menores temperaturas, pueden haber sido el lugar de aparición de los primeros ciclos metabólicos. Además, se ha demostrado recientemente que en las fumarolas blancas alcalinas se puede originar un amplio rango de moléculas orgánicas pequeñas (metanol, ácido fórmico, ácido acético, ácido pirúvico) por la reducción de CO2 en presencia de minerales como la greigita (Roldan y cols. 2015).
Si el progenote hubiese comenzado en uno de estos microambientes, todavía desprovisto de pared celular, se explicaría además una diferencia fundamental entre algunos tipos de seres vivos. Es de sobra conocido que todos los seres vivos que han poblado la Tierra se pueden clasificar en tres dominios: Arqueas (micro-organismos unicelulares sin núcleo ni organelas), Eucariotas (las células más complejas, con un sistema de membranas internas que envuelven estructuras como el núcleo o las organelas celulares) y Bacterias (micro-organismos sin núcleo, presentes en muchos hábitats distintos del planeta). Pues bien, mientras que Bacterias y Eucariotas tienen en sus membranas celulares fosfolípidos basados en ésteres de glicerol-3-fosfato, los fosfolípidos de la pared celular de Arqueas consisten en éteres de glicerol-1 fosfato. Tal diferencia es poco plausible si LUCA hubiese tenido membranas formadas íntegramente por uno de estos dos tipos de lípidos, lo que sugiere que las membranas lipídicas podrían haber aparecido posteriormente.
En cualquiera de estos posibles escenarios, las teorías más recientes permiten pensar que gradualmente se fueron formando soluciones concentradas de los distintos tipos de monómeros y biopolímeros. En un momento dado, estas soluciones habrían coexistido con sistemas metabólicos primitivos, en presencia de moléculas anfifílicas capaces de formar vesículas. En estas primeras protocélulas sería crucial la presencia de catalizadores orgánicos y organometálicos (aminoácidos, fosfatos, boratos y silicatos), que evitarían la degradación de los distintos componentes y permitirían estabilizar los intermediarios de muchas de las reacciones. Al final del proceso, el sistema se organizaría en un conjunto de redes de interacción que permitirían su sostenibilidad y replicación.
En cualquier caso, la aparición del LUCA tuvo que ser probablemente un fenómeno local y único, pues de lo contrario resulta difícil de explicar la universalidad de los sistemas genéticos y metabólicos, así como el hecho de que algunas biomoléculas tienen siempre el mismo tipo de forma espacial (ver enantiómeros de aminoácidos y azúcares en el apéndice). Otra posible explicación de este fenómeno podrían ser los meteoritos, ya que en el meteorito Murchison hay un exceso enantiomérico de L-alanina (dos veces más frecuente que D-alanina) y de L-aspártico. Pero también podrían haberse generado excesos enantioméricos en la tierra prebiótica, ya que la formación de cristales de aminoácidos (mediante ciclos de evaporación y concentración) favorece la formación de excesos enantioméricos. Además, algunas superficies minerales o cristales de calcita retienen preferentemente en su superficie aminoácidos de una forma enantiomérica concreta.
8 Cuestiones abiertas ↑
Todo lo expuesto hasta ahora sugiere que mecanismos puramente naturales podrían ser suficientes para explicar la aparición de organismos vivos a partir de sistemas químicos complejos. Con los datos existentes en la actualidad, no resulta descabellado proponer que las primeras formas de vida se originaron a partir de biomoléculas y ciclos metabólicos a los que se había llegado mediante evolución química. Tal postura, evidentemente, es irreconciliable con el creacionismo, entendido como la creación directa e inmediata por parte de Dios de cada uno de los seres vivos que han existido sobre la Tierra, bien en un único acto o en una serie de actos sucesivos. En el contexto de este tipo de creacionismo, cualquier modelo de evolución resulta inaceptable.
En cambio, desde una perspectiva filosófica más amplia, el origen de la vida mediante causas naturales resulta aceptable tanto desde posturas ateas como teístas. Para el ateísmo, el mundo material es lo único que existe y por tanto no es necesario acudir a ningún agente externo para dar razón de procesos que pueden ser explicados mediante causas naturales (aunque debe explicar la existencia misma del mundo material o de las leyes por las que se rige). Por lo que respecta al teísmo, un acto creador consistiría en la aparición ex nihilo de un Universo dotado de unas propiedades y unas leyes internas específicas que harían posible la aparición de la vida, sin necesidad de intervenciones posteriores una vez que el proceso se ha iniciado. En este contexto, las mismas leyes naturales que estudia la ciencia experimental se consideran causas segundas a través de las cuales se despliega el impulso creador de la causa primera. Al contrario de lo que sucede con el dios del creacionismo, el Dios del teísmo sería la “Mente” cuyo proyecto creador se despliega en el tiempo por medio de leyes naturales auto-contenidas que conducen a la organización de la materia en niveles de complejidad cada vez mayores, uno de cuyos resultados es la aparición de seres vivos.
Probablemente nunca llegaremos a saber a ciencia cierta los pasos concretos que se dieron durante la aparición de la vida sobre la Tierra. En cualquier caso, conocer las líneas maestras de este proceso permite llevar a cabo una discusión acerca de cuestiones más amplias. Por ejemplo, ¿es la aparición de la vida una rareza estadística o por el contrario resulta inevitable siempre que se dan las condiciones físico-químicas adecuadas? ¿Es la vida (tal y como la conocemos en nuestro planeta) una propiedad presente en todo el Universo, o específica de la Tierra?
El estudio de las propiedades mismas de la materia (sin entrar en la discusión filosófica sobre su sentido y origen último) también debería arrojar algo de luz sobre la cuestión de la existencia de lo vivo. Ya Schrödinger propuso hace años que los seres vivos constituyen sistemas abiertos que mantienen su baja entropía a base de aumentar la del medio que los rodea. Considerando de modo general la complejidad de los componentes que constituyen un sistema vivo (la molécula autoreplicativa portadora de información, el sistema metabólico y la membrana que los encapsula dentro de una vesícula), los organismos vivos se configuran como sistemas dinámicos complejos no-lineales alejados del equilibrio termodinámico al modo de las estructuras disipativas popularizadas por Prigogine. Tales sistemas favorecerían la auto-organización y la emergencia de nuevas propiedades con una complejidad creciente (Prigogine y Stengers 1984), pero todavía no contamos con una explicación detallada de cómo suceden estos fenómenos.
Al nivel biológico se está abordando esta cuestión desde la Biología de Sistemas. Ya a finales de los años 60, Kauffman utilizó modelos de redes genéticas sencillas para proponer que una célula podría llegar a describirse como un atractor en un sistema dinámico. A lo largo de los años se ha comprobado que diversos sistemas autocatalíticos se comportan de hecho como atractores, lo que permite conjeturar que los sistemas vivos surgen mediante la auto-organización de sistemas dinámicos alejados del equilibrio, cuando los parámetros del sistema alcanzan una solución que se convierte en un atractor estable (Kauffman 1993). En nuestros días, la Química de Sistemas es el campo que intenta comprender cómo pudo darse la transición de sistemas químicos complejos a sistemas biológicos (muchísimo más complejos que los químicos), precisamente trabajando a partir de conceptos como “autocatálisis” y “redes complejas de reacciones químicas” (Ruiz-Mirazo y cols. 2014).
En este contexto, la noción de “información” cobra especial relevancia. Como dice Artigas, el concepto de información juega un papel central en los procesos naturales: la información biológica viene codificada en estructuras dinámicas y -a su vez- permite que se originen nuevas estructuras (Artigas 2003). El problema es comprender cómo una abstracción (información) puede llegar a tener eficacia causal en sistemas biológicos. Algunos autores, entre los que destaca el físico Paul Davies, proponen que los sistemas vivos funcionan mediante una causalidad de arriba hacia abajo (top-down) que se implementa mediante estructuras de control de la información y por la selección adaptativa entre clases funcionales equivalentes. De este modo, ciertos patrones de organización sistémica de alto nivel (celular o tisular, por ejemplo) podrían canalizar lo que sucede a un nivel molecular más elemental, dando lugar a eventos causales específicos.
Para los autores que siguen estas propuestas, el problema de explicar el origen de la vida no se centraría tanto en la aparición de los componentes moleculares de los seres vivos (lo que equiparan al hardware), sino en la emergencia de información (el software). Los componentes celulares, tanto las moléculas que transmiten la información genética como los sistemas metabólicos, son estructuras físicas portadoras de información (digital o analógica, respectivamente), pero lo que permite la aparición de un sistema vivo es la información de naturaleza algorítmica mediante la cual el sistema es capaz de replicarse a sí mismo. La pregunta fundamental, por tanto, es cómo pudo un sistema meramente químico (el hardware) producir un software capaz de replicar tanto el hardware como el mismo software. Davies retoma el trabajo de John Von Neumann en torno al constructor mecánico, un autómata con una estructura lógica capaz de replicar tanto su hardware como su software, e intenta aplicar ese mismo concepto a la Biología (Walker y Davies 2012). El concepto de información requerido por estos sistemas supone que la información genética sólo cobraría sentido dentro de un contexto biológico o ecológico más amplio, que ejercería algún tipo de causación top-down sobre los componentes moleculares más elementales.
Al nivel más básico (el nivel físico), también hay intentos recientes de explicar la existencia de seres vivos como sistemas dinámicos alejados del equilibrio. Partiendo de diversos desarrollos matemáticos que predicen el comportamiento de estos sistemas, se ha visto recientemente que si un grupo de átomos es sometido a una fuente externa de energía y está rodeado por un reservorio térmico (como la atmósfera o el océano, que capturan energía), el sistema se re-estructurará para disipar cada vez más calor, lo que hace que aumente su orden interno. En otras palabras: bajo ciertas condiciones, la materia muestra una tendencia inherente a adquirir orden interno. Partiendo de aquí, físicos como Jeremy England están desarrollando el aparato matemático que explicaría el comportamiento de un sistema de partículas que recibe energía del exterior y puede cederla al reservorio que lo rodea. Se puede formalizar cómo dicho sistema iría cambiando a medida que se aleja del equilibrio, aumentando progresivamente su orden interno al reordenarse los átomos para aprovechar mejor la energía que recibe. Al parecer, lo que “mueve” este proceso es que la materia va adaptándose a medida que disipa cada vez más energía. En otras palabras, habría una cierta relación entre la segunda ley de la termodinámica y la auto-organización de la materia. Esta auto-organización tendría que ver, por tanto, con la maximización de la información y de la cantidad de energía aprovechada por el sistema (absorbida como energía de baja entropía y expulsada como energía de alta entropía). Si las fórmulas y las predicciones experimentales resultan ser acertadas, esto supondría un avance muy significativo para aclarar uno de los puntos más debatidos sobre el origen de la vida. Dado que esta propiedad de configurarse como un sistema alejado del equilibrio es la principal característica de los seres vivos, la investigación en este campo es fundamental para entender cómo pudo darse el paso de lo no vivo a lo vivo.
9 Bibliografía ↑
Artigas, M. 2003. “Causality, Primary and Secondary”. En Encyclopedia of Science and Religion. Consultado el 17 de noviembre de 2015. URL= http://www.encyclopedia.com/doc/1G2-3404200071.html
Attwater, J., A. Wochner y P. Holliger. 2013. “In-ice evolution of RNA polymerase ribozyme activity”. Nat. Chem. 5:1011–1018.
Bada, J.L. 2013. “New insights into previotic chemistry from Stanley Miller’s spark discharge experiments”. Chem. Soc Rev. 42:2186-2196.
Cech, T.R. 2012. “The RNA worlds in context”. En Cold Spring Harb. Perspect. Biol. 4:a006742.
Cronin, J.R. y S. Chang. 1993. “Organic matter in meteorites: Molecular and isotopic analyses of the Murchison meteorite”. En The Chemistry of Life’s Origins, editado por GREENBERG JM, MENDOZA-GOMEZ CX, PIRANELLO V. Kluwer Academic Publishers.
Dyson, F.J. 1982. “A model for the origin of life”. J. Mol. Evol. 18:344-50.
Hardy, M.D., J. Yang, J. Selimkhanov, C.M. Cole, L.S. Tsimring y N.K. Devaraj. 2015. “Self-reproducing catalyst drives repeated phospholipid synthesis and membrane growth”. Proc. Natl Acad. Sci. U.S.A. 112: 8187-8192.
Johnson, A.P., H.J. Cleaves, J.P. Dworkin, D.P. Glavin, A. Lazcano y J.L. Bada. 2008. “The Miller Volcanic Spark Discharge Experiment”. Science 322:404.
Jorgensen J.K., C. Favre, S.E. Bisschop, T.L. Bourke, E.F. Van Dishoeck y M. Schmalzl. 2012. “Detection of the simplest sugar, glycolaldehyde, in a solar-type protostar with ALMA”. The Astrophysical Journal Letters 757:L4 (6pp).
Kauffman, S. 1993. “The origins of order: self-organization and selection in evolution”. Oxford University Press.
Lincoln, T.A. y G.F. Joyce. 2009. “Self-sustained replication of an RNA enzyme”. Science 323:1229-1232.
López-Sepulcre, A., A.A. Jaber, E. Mendoza, B. Lefloch, C. Ceccarelli, C. Vaster, R. Bachiller, J. Cernicharo, C. Codella, C. Kahane, M. Kama, M. Tafalla. 2015. “Shedding light on the formation of the pre-biotic molecule formamide with ASAI”. Monthly Notices of the Royal Astronomical Society 449:2438–2458.
Malyshev, D.A., D. Kirandeep, T. Lavergne, T. Chen, N. Dai, J.M. Foster, I.R. Correa y F.E. Romesberg. 2014. “A semi-synthetic organism with an expanded genetic alphabet”. Nature 509:385-388.
Martin, W.F., F.L. Sousa y N. Lane. 2014. “Energy at life’s origin”. Science 344:1092-1093.
Martins, Z., O. Botta, M.L. Fogel, M.A. Sephton, D.P. Glavin, J.S. Watson y otros. 2008. “Extraterrestrial nucleobases in the Murchison meteorite”. Earth and Planetary Science Letters 270:130–136.
Öberg, K.I., V.V. Guzmán, K. Furuya, C. Qi, Y. Aikawa, S.M. Andrews, R. Loomis y D.J. Wilner. 2015. “The comet-like composition of a protoplanetary disk as revealed by complex cyanides”. Nature 520:198-201.
Pasek, M.A., J.P. Harnmeijer, R. Buick, M. Gull y Z. Atlas. 2013. “Evidence for reactive reduced phosphorus species in the early Archean ocean”. Proc. Natl Acad. Sci. U.S.A. 110:10089-10094
Patel, B.H., C. Percivalle, D.J. Ritson, C.D. Duffy y J.D. Sutherland. 2015. “Common origins of RNA, protein and lipid precursors in a cyanosulfidic protometabolism”. Nat. Chem. 7:301-7.
Powner, M.W., B. Gerland y J.D. Sutherland. 2009. “Synthesis of activated pyrimidine ribonucleotides in prebiotically plausible conditions”. Nature 459:239-42.
Prigogine, I. e I. Stengers. 1984. “Order out of Chaos: Man's new dialogue with nature”. Flamingo.
Ricardo, A. y J. Szostak. 2009. “Life on Earth”. Scientific American.
Roldan, A., N. Hollingswowrth, A. Roffrey, H-U. Islam, J.B.M. Goodall, C.R.A. Carlow y otros. 2015. “Bio-inspired CO2 conversion by iron sufide catalysts under sustainable conditions”. Chem. Commun. 51:7501-7504.
Ruiz-Mirazo, K., C. Briones, A. De La Escosura. 2014. “Prebiotic Systems Chemistry: new perspectives for the Origins of Life”. Chem. Rev. 114:285-366.
Saladino, R., E. Carota, G. Botta, M. Kapralov, G.N. Timoshenko, A.Y. Rozanov, E. Krasavin y E. Di Mauro. 2015. “Meteorite-catalyzed syntheses of nucleosides and of other prebiotic compounds from formamide under proton irradiation”. Proc. Natl. Acad. Sci. USA. 112:E2746-55.
Service, R.F. 2013. “The Life Force”. Science, 342:1032-1034.
Wacey, D., M.R. Kilburn, M. Saunders, J. Cliff y M.D. Brasier. 2011. “Microfossils of sulphur-metabolizing cells in 3.4-billion-year-old rocks of Western Australia”. Nature Geoscience 4:698–702.
Wächtershäuser, G. 1990. “Evolution of the First Metabolic Cycles”. Proc. Natl. Acad. Sci. USA. 87:200-204.
Walker, S.I. y P.C.W. Davies. 2012. “The algorithmic origins of life”. J. R. Soc. Interface 10: 20120869.
Wochner, A., J. Attwater, A. Coulson y P. Holliger. 2013. “Ribozyme-catalyzed transcription of an active ribozyme”. Science 332:209-212.
Yang, D., S. Peng, M.R. Hartman, T. Gupton-Campolongo, E.J. Rice, A.K. Chang y otros. 2013. “Enhanced transcription and translation in clay hydrogel and implications for early life evolution”. Sci. Rep. 3:3165.
Zimmer, C. 2009. “On the Origin of Life on Earth”. Nature 323:198-199.
10 Apéndice: Algunas moléculas importantes ↑
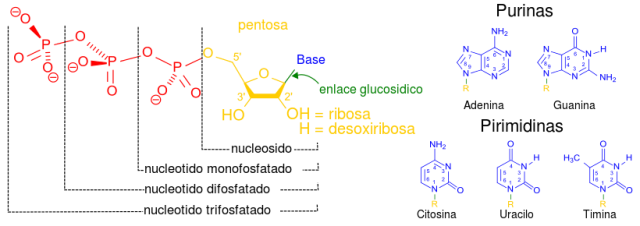
1. Nucleótido
Un ácido nucleico es una cadena más o menos larga (polímero) de unidades llamadas nucleótidos. Un nucleótido es una molécula formada por un azúcar (ribosa o desoxi-ribosa), una nucleobase (adenina, timina, citosina, guanina o uracilo) y entre 1 a 3 grupos fosfato unidos a un extremo del azúcar. Tres de las nucleobases (citosina, timina y uracilo) se denominan pirimidinas, mientras que las otras dos (adenina y guanina) son purinas. El ADN (ácido desoxi-ribonucleico) lleva desoxi-ribosa como azúcar, y sólo contiene A, C, G y T. Por el contrario el ARN (ácido ribonucleico) lleva ribosa, y en vez de timina contiene uracilo.
Las cadenas de polinucleótidos se forman por enlaces químicos entre el azúcar de un nucleótido (su extremo 3’) con el grupo fosfato del siguiente nucleótido (extremo 5’) y así sucesivamente siempre en esa dirección (que se denomina dirección 5’ --> 3’).
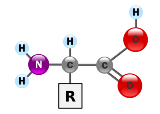
2. Aminoácido
Las proteínas son polímeros, cadenas largas formadas por la unión de aminoácidos. Un aminoácido consta de un carbono al que se unen un grupo amino y un grupo carboxilo, además de otra molécula que es la que distingue unos aminoácidos de otros.
Por sus características, los aminoácidos pueden adoptar dos formas espaciales que son como imágenes especulares, llamadas enantiómeros. Se denominan L-aminoácidos (de “levo” o izquierda) y D-aminoácidos (“dextro” o derecha). Curiosamente, todos los aminoácidos naturales son de la forma L.
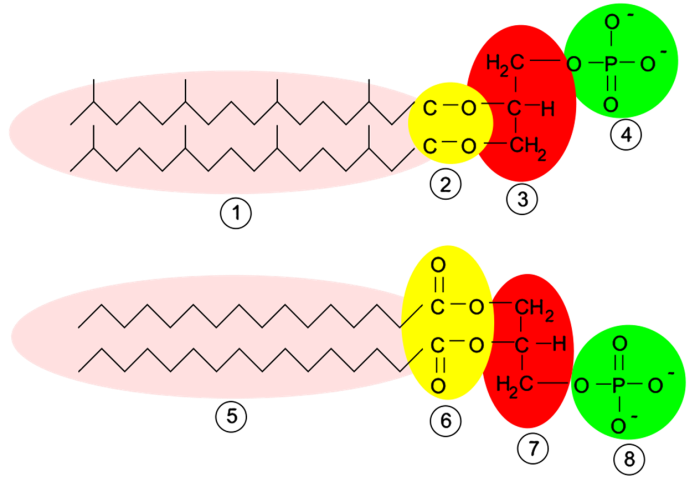
3. Fosfolípido
Las membranas de los seres vivos están formadas por unos lípidos especiales llamados fosfolípidos. La estructura básica de un fosfolípido es una molécula de glicerol (números 3 y 7 en la imagen, en rojo), un grupo fosfato (números 4 y 8, en verde) y dos cadenas de ácidos grasos (números 1 y 5, en rosa). La parte del grupo fosfato es soluble en agua (hidrofílica), mientras que los ácidos grasos repelen el agua (hidrofóbicos). Por eso se dice que estas moléculas son anfipáticas y cuando están en agua forman monocapas o bicapas con la parte hidrofílica hacia fuera y las colas hidrofóbicas hacia dentro.
Los fosfolípidos de las membranas celulares de Arqueas tienen enlaces tipo éter (número 2, amarillo) entre la molécula de glicerol y las cadenas laterales, mientras que Bacterias y Eucariotas tienen enlaces tipo éster (número 6, amarillo).
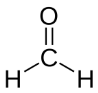
4. Formaldehído y Glicolaldehído
El formaldehído es una molécula orgánica que constituye el aldehído más simple (un aldehído es un carbono unido por un enlace simple a un hidrógeno y por un enlace doble a un oxígeno).
El glicolaldehído es la molécula orgánica más simple posible con un aldehído y un hidroxilo (un radical HO unido a un carbono). Se forma por la unión de dos moléculas de formaldehído, y es un intermediario importante en la síntesis de azúcares.
Tanto el formaldehído como el glicolaldehído han sido detectados en sistemas estelares lejanos.
5. Otros compuestos prebióticos
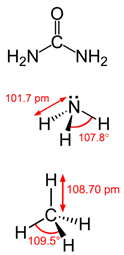
Algunos compuestos orgánicos prebióticos de interés para la química del origen de la vida son la urea (figura superior), el amoniaco (figura del medio) y el metano (figura inferior).
La urea fue el primer compuesto orgánico sintetizado a partir de dos moléculas inorgánicas, y también se ha detectado en el espacio interestelar.
El amoniaco es una de las principales fuentes de nitrógeno de los organismos vivos, y también está presente en otros planetas del sistema solar y en el espacio interestelar.
El metano es el compuesto de carbono más sencillo, y está presente en casi todos los planetas del sistema solar, en exoplanetas y en el espacio interestelar.
11 Cómo Citar ↑
Novo, Francisco J. 2015. "Origen de la vida". En Diccionario Interdisciplinar Austral, editado por Claudia E. Vanney, Ignacio Silva y Juan F. Franck. URL=http://dia.austral.edu.ar/Origen_de_la_vida
12 Derechos de autor ↑
DERECHOS RESERVADOS Diccionario Interdisciplinar Austral © Instituto de Filosofía - Universidad Austral - Claudia E. Vanney - 2015.
13 Herramientas académicas ↑
Exploring Life’s origins (http://exploringorigins.org/index.html). Página web del laboratorio de Jack Szostak, con videos y explicaciones sobre los procesos de síntesis de las diversas estructuras necesarias para formar las primeras protocélulas.
Miller-Urey experiment – Creación del consorcio C3BC. (http://en.wikipedia.org/wiki/File:Miller-Urey_experiment_-_Work_by_the_C3BC_consortium,_licensed_under_CC-BY-3.0.webm).
14 Agradecimientos ↑
El presente texto tiene su origen en un seminario pronunciado en el año 2012 en el grupo de investigación “Ciencia, Razón y Fe” (CRYF) de la Universidad de Navarra, y ha sido enriquecido con las reflexiones y discusiones mantenidas desde entonces con miembros de este grupo, en particular con el Prof. Javier Sánchez-Cañizares. El autor también agradece los comentarios y sugerencias de dos revisores anónimos.